Dieser Beitrag aus der Reihe Neue Wege zur Gesundbeit befasst sich mit den biogenen Polyaminen und deren Hauptvertreter Spermidin. Polyamine zählen zu den organischen Verbindungen und sind für den menschlichen Stoffwechsel essenziell. Eine wichtige Rolle spielen außerdem die unscheinbaren Weizenkeime, die eine hervorragende Quelle zur Aufnahme von Polyaminen sind. Ihre Inhaltsstoffe wirken sich nicht nur positiv auf die Gesundheit aus, sie unterstützen auch die Effekte der Polyamine. Die Wissenschaft liefert vermehrt belastbare Daten, die den gesundheitlichen Nutzen dieser Stoffe belegen und ihre Bedeutung im Rahmen der orthomolekulare Mikronährstoff-Therapie bestärken.
— ein Übersichtsartikel von Dr. med. Udo Böhm —
Die Polyamine — Organische Verbindungen mit großen Aufgaben
Die Gruppe der Polyamine kann unterteilt werden in Spermidin und Spermin sowie in Putrescin und Cadaverin. Diese natürlichen Verbindungen sind alle ein notwendiger Bestandteil des menschlichen und tierischen Stoffwechsels.
Der Naturforscher und Mikroskopiker Antonie van Leeuwenhoek (1632 bis 1723) entdeckte die Polyamine bereits im Jahre 1678 und beschrieb sie als „Kristalle“ in der menschlichen Samenflüssigkeit. Doch erst 248 Jahre später, im Jahr 1926, klärten die Biochemiker Otto Rosenheim, Walter William Starling und Harold Dudley die chemische Struktur von Spermin. Darüber hinaus fanden sie in Gewebeextrakten einen weiteren Stoff – das Spermidin [6, 7].
Medizin und Forschung zeigen aktuell verstärkt Interesse an den Polyaminen. Die organischen Verbindungen sind in viele Funktionsprozesse eingebunden und auch ihre Aufgaben im Stoffwechsel sind weitgehend bekannt. Diese Erkenntnisse sind für die Forschung sehr wichtig, denn sie vervollständigen das Bild von den Abläufen im menschlichen Organismus. Dieses Wissen ermöglicht einen optimierten Umgang mit belastenden Erkrankungen. Auch die Versorgung mit Polyaminen, die sowohl präventiv als auch im Rahmen einer Therapie eingesetzt werden können, kann in Zukunft verbessert werden.
Polyamine sind maßgeblich an der Entwicklung vieler Zellen beteiligt und sichern zudem deren Überleben. Spermidin ist aufgrund seiner besonderen polykationischen Eigenschaften das effektivste Polyamin [34]. Für eine gute Gesundheit ist dennoch das Gleichgewicht aller Polyamine, insbesondere das Verhältnis zwischen Spermin und Spermidin, im Körper entscheidend. Dies bedeutet aber auch, dass sich schon eine kleine Störung im Polyamin-Stoffwechsel negativ auswirken kann.
Verfügbarkeit, Bedarf und Stoffwechsel der Polyamine
Die drei Polyamine Spermin, Spermidin und Putrescin können sowohl über die Nahrung zugeführt als auch vom Körper selbst gebildet werden. Lebensmittel enthalten die einzelnen Polyamine in unterschiedlichen Mengen. Spermidin kommt besonders reichlich in Weizen und Weizenkeimen vor. Aber auch getrocknete Sojabohnen, gereifter Cheddarkäse, grüne Erbsen und Pilze enthalten Spermidin und andere Polyamine [1, 47, 67, 68].
Spermin und Spermidin können im Darm transepithelial („durch die Darmschleimhaut hindurch“) gut absorbiert werden. Putrescin hingegen kann weniger gut aufgenommen werden, da es von der sich im Darm befindlichen Diaminoxidase (DAO) abgebaut wird [37, 47]. Damit der Körper Polyamine selbst herstellen kann, benötigt er die Aminosäuren Arginin oder Ornithin sowie verschiedene Co-Faktoren wie Vitamin B12, Folsäure und S-Adenosyl-Methionin (kurz: SAM; wird über den 1-Carbonweg zur Verfügung gestellt).
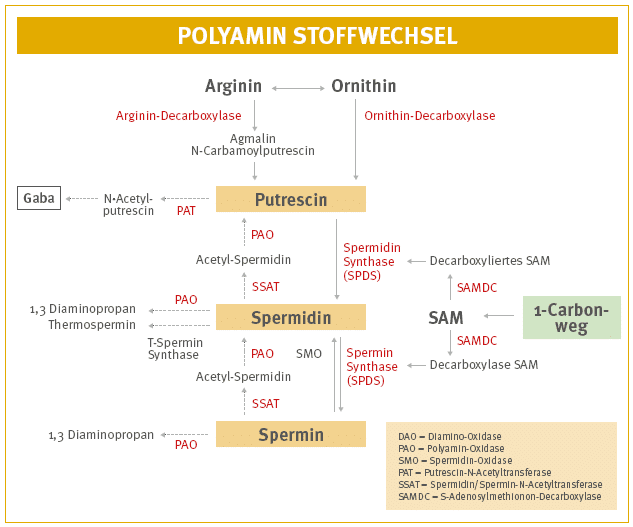
Darüber hinaus sind am Polyamin-Stoffwechsel etliche Enzyme beteiligt. Darunter zum Beispiel die Spermidin- und Spermin-Synthase, die Arginin- und Ornithin-Decarboxylase, die Enzyme des 1-Carbonweges, die Polyamin-Oxidase sowie die vom Histamin-Stoffwechsel bekannte Diamin-Oxidase (DAO). Bei diesem Prozess entsteht zunächst Putrescin, welches zu Spermidin verstoffwechselt wird, welches anschließend zu Spermin umgewandelt werden kann.
Als weitere mögliche Polyamin-Quelle kommen Darmbakterien infrage: In einem Experiment mit Ratten konnte nachgewiesen werden, dass Darmbakterien durch Fermentation Polyamine produzieren [43, 44, 59]. Außerdem existieren Hinweise, dass Präbiotika (unverdauliche Ballaststoffe; Energiequelle für Darmbakterien) die Ornithindecarboxylase stimulieren und somit die Polyamin-Synthese erhöhen können [53].
Der Polyamin-Bedarf muss zu rund zwei Dritteln über die Ernährung gedeckt werden, denn der Körper kann nur rund ein Drittel selbst herstellen. Bisher liegen kaum verwertbare Daten vor, die Rückschlüsse auf den Polyamin-Bedarf und eine mögliche zusätzliche Dosierung zulassen. Einer japanischen Quelle zufolge sollte eine tägliche Aufnahme von 70 Milligramm (einschließlich Eigensynthese) erreicht werden [47].
Ältere Menschen ab 60 Jahren neigen zu geringen Polyamin-Konzentrationen. In einer Untersuchung von Pucciarelli und Kollegen mit 78 Teilnehmern, die in drei altersabhängige Gruppen eingeteilt wurden, erreichten Probanden im Alter von 60 bis 80 Jahren die niedrigsten Spermidin- und Spermin-Konzentrationen im Blut. Teilnehmer, die über 90 Jahre alt waren, besaßen hingegen verhältnismäßig höhere Spermin-Konzentrationen [52].
Für ein gesundes Wachstum und eine normale Entwicklung ist die gesamte Polyamin-Homöostase und insbesondere die Spermidin-Spermin-Homöostase wichtig. Der Stoffwechselweg der einzelnen Substanzen funktioniert in beide Richtungen. Über verschiedene Regulationsmechanismen wird die Homöostase unter Einbeziehung der Biosynthese, Aufnahme, Degradierung und Ausscheidung aufrechterhalten.
Zu den Regulationsmechanismen gehören auch das sogenannte ODC-Antizym (ODC-AZ) und der Antizym-Inhibitor (AZIN1). Die Ornithindecarboxylase (ODC) löst die Umwandlung von Ornithin zu Putrescin aus. Das ODC-Antizym hemmt bei einem hohen Polyamin-Spiegel die Ornithindecarboxylase. Der Antizym-Inhibitor kann sich an die Ornithindecarboxylase binden, diese stabilisieren und dadurch die antizymvermittelte ODC-Degradierung hemmen [19, 36, 48, 54].
Auch N-Acetyltransferasen sind für die Feinregulierung der Polyamin-Konzentrationen in den Zellen sowie den Polyamin-Transport außerhalb der Zellen wichtig. Des Weiteren katalysieren sie den Austausch eines Wasserstoffatoms durch eine Acetylgruppe (sogenannte Acetylierung). Hiervon betroffen sind die Substanzen Spermidin, Spermin und Putrescin. Bildet das SAT1-Gen (Spermidin/Spermin N1-Acetyltransferase 1) hingegen zu viele N-Acetyltransferasen, führt dies zu einer schnellen Entfernung von Spermidin und Spermin aus dem Körper. Dadurch wird die Proteinsynthese gehemmt und es kommt zum Wachstumsstillstand in Säugetierzellen [32].
Der Polyamin-Bedarf, insbesondere der Spermidin-Bedarf, ist aufgrund des gesteigerten Zellwachstums in der Schwangerschaft und bei Säuglingen in den ersten 28 Tagen nach der Geburt erhöht. Auch Schadstoffbelastung oder die Ausübung eines Leistungssports können den Bedarf ansteigen lassen. Darüber hinaus können sich Umwelteinflüsse und der Hormonstatus auf die Polyamin-Synthese und den Polyamin-Gesamtpool auswirken. Mit dem Alter nimmt zudem die körpereigene Herstellung ab, wodurch die gesamte Polyamin-Konzentration sinkt [41, 46, 4].
Ein Mangel an Grundsubstanzen, bestimmte genetische Merkmale und Störungen der Darmfunktion können dazu führen, dass der Körper nicht oder nicht ausreichend mit Polyaminen versorgt werden kann. Stehen dem Organismus dauerhaft zu wenige Polyamine zur Verfügung oder kommt es zu einer Störung der Spermidin-/Spermin-Homöostase, löst dies zahlreiche krankhafte Prozesse aus [39, 54].
Die Wirkungen der Polyamine auf den Stoffwechsel
Mittlerweile ist bekannt, dass Polyamine die Gesundheit auf vielfältige Weise unterstützen. Sie spielen eine tragende Rolle in der Entwicklung, unterstützen die normale Funktionsfähigkeit gesunder Zellen und erhalten den Stoffwechsel bei Mensch und Tier aufrecht. Die vorliegenden wissenschaftlichen Daten beziehen sich hauptsächlich auf die beiden wichtigsten Vertreter Spermin und Spermidin.
Die Polyamine sind zunächst an der Weitergabe genetischer Informationen für die Biosynthese von Proteinen im Rahmen der so genannten Genexpression beteiligt. Anschließend modulieren sie bei der Proteinbildung die Übertragung der genetischen Informationen von der DNA auf die RNA (sogenannte Transkription) und die Übersetzung der Informationen von der mRNA auf die Proteine (sogenannte Translation). Die Polyamine steuern auch Enzyme wie die Proteinkinasen (Phosphotransferasen), die den Transfer einer Phosphatgruppe von einem Donor („Spender“) auf eine Aminosäure katalysieren [4, 19, 23, 32, 36, 39, 48, 49, 52].
Darüber hinaus beeinflussen Polyamine die Synthese der Nukleinsäuren sowie die Struktur der DNA und der Ribonukleinsäuren mRNA (Boten-RNA), rRNA (ribosomale RNA) und tRNA (Transfer-RNA). Sie regulieren außerdem die DNA- und RNA-Polymerasen (katalysieren die Synthese von DNA und RNA) und die DNA-Topoisomerasen (verändern die Form der DNA-Moleküle).
Polyamine nehmen erheblichen Einfluss auf die Reifeteilung einzelner Zellen, da sie den Austausch von DNA-Sequenzen bei der Konversion von DNA-Molekülen modulieren. Des Weiteren stabilisieren sie die negative Ladung (d. h. überschüssige Elektronen) von DNA-Molekülen, der aufgrund der Phosphat-Komponenten entsteht. Auch RNA-Untereinheiten des endoplasmatischen Retikulums (wichtiges Zellorganell) werden durch die Polyamine stabilisiert. Dies ist möglich, weil viele Polyamine in den Zellen als RNA-Polyamin-Komplex existieren [4, 19, 36, 48, 49, 52].
Weiterhin beeinflussen sie die Aktivität von Wachstumsfaktoren. Die Polyamine interagieren mit Phospholipiden, tragen zur Stabilität der Membranen bei und schützen diese vor Lyse (Schädigung/Auflösung der äußeren Zellmembran). Dadurch sind sie auch an der Strukturierung zellulärer Makromoleküle und am Gewebewachstum beteiligt [4, 19, 23, 26, 32, 39, 41, 48, 49, 52].
Auch bei der Steuerung von Ionenkanälen ist der Organismus auf Polyamine angewiesen. Ionenkanäle sind porenbildende Transmembranproteine, die vor allem für die Erregbarkeit von Sinnes-, Muskel- und Nervenzellen verantwortlich sind. Zu den Ionenkanälen gehören zum Beispiel Kalium- und Calciumkanäle (K+ und Ca++) sowie die NMDA-Rezeptoren, welche den Ionenfluss an den Synapsen beeinflussen. Die Polyamine wirken als NMDA-Antagonisten und blockieren die Glutamat-Bindungsstellen der Rezeptoren [19, 39, 48, 49].
Zudem sind Polyamine mit in die Differenzierung von Immunzellen und in die Entwicklung des Immunsystems eingebunden. Sie regulieren außerdem die Immun- und Entzündungsantwort [23, 39, 41].
Desweiteren entfalten sie antioxidative Effekte und schützen den Körper somit vor Schäden durch freie Radikale [41, 48, 49].
Polyamine sind an der Reifung des Darms eines Neugeborenen beteiligt, ebenso wie an Wachstum, Entwicklung sowie Reparaturprozessen der Darmschleimhaut und der Aufrechterhaltung der Darmfunktionen beteiligt [23, 26, 39, 41].
Heutzutage ist außerdem bekannt, dass Polyamine die männliche Fortpflanzungsfähigkeit beeinflussen, da sie sich auf den Hormonstoffwechsel auswirken und hierbei die Zellantwort auf Hormone (zum Beispiel Androgene) kontrollieren und auf einzelne Zellen sowie die Zellumgebung einwirken [4].
Gesundheit und Krankheit: Was Polyamine erreichen können
Trotz der vielen o. g. Studien zu den Wirkmechanismen diverser Polyamine liegen aktuell nur wenige Untersuchungsergebnisse über die praktischen Auswirkungen der gesamten Polyamin-Gruppe auf Gesundheit und Krankheit im Rahmen gezielter therapeutischer Interventionsmaßnahmen vor. Nichtsdestotrotz werden jedoch immer mehr positive Berichte über Spermidin verbreitet.
Das bisherige Wissen über die Funktionen der organischen Verbindungen im Stoffwechsel sowie weitere Materialien lassen vermuten, dass die Polyamine zumindest bei Alterungsprozessen, neurodegenerativen Krankheiten, Stoffwechselstörungen, in der Krebsprävention sowie in Bezug auf die Gedächtnisleistung eine eigenständige Rolle spielen.
Auch günstige Effekte bei Fettstoffwechselstörungen (Dyslipidämie), Wundheilungsprozessen, Thrombozytenaggregation (Verklumpung von Blutplättchen), Lipidperoxidation (oxidative Degradation von Lipiden; kann zu Zellschäden führen)) und Hyperglykämie (hoher Blutzuckerspiegel) wurden beschrieben. Hierbei zeigte der experimentelle Einsatz von Polyaminen auch positive Wirkungen bei Diabetes bzw. bei diabetischen Komplikationen sowie bei der Prävention der Glykierung von Hämoglobin (mit Zuckerresten verknüpftes Hämoglobin). Vermutlich können sie auch kardiovaskulären Störungen und anderen chronischen Erkrankungen vorbeugen [34, 39, 41].
Laut Baroli können Polyamine sogar das Gehirn vor der Entwicklung von psychischen Erkrankungen und Epilepsie schützen. Eine therapeutische Veränderung des Polyamin-Stoffwechsels könnte die Prävention und Behandlung dieser Krankheiten deutlich verbessern [15]. Madeo verbindet hohe Polyamin-Spiegel zudem mit einer verbesserten Gesundheit und einer reduzierten Gesamtmortalität (Sterberate) [31]. Diese Vermutung wurde durch die Entdeckung erhöhter Polyamin-Spiegel bei gesunden Menschen im Alter von 90 bis 100 Jahren bekräftigt. Auch Ilgarashi schreibt den Polyaminen eine große Bedeutung zu, da ein erhöhter Spiegel an Polyaminoxidasen und Acrolein (entsteht aus Polyaminen) gute Marker für einen Schlaganfall und chronische Nierenschäden sind [19]. Jedoch existiert aktuell noch kein einheitliches Konzept, welches die gesamten biochemischen und molekularen Funktionen der Polyamine beschreiben kann [36].
Die besonderen Wirkungen von Spermidin (im Vergleich zu anderen Polyaminen)
Spermidin (1,8-Diamino-4-azaoctane, N-(3-Aminopropyl)-1,4-Diaminobutan oder Monoaminopropylputrescin) ist das am besten erforschte und auffälligste Polyamin. Es ist wesentlich an der Aufrechterhaltung des gesamten Stoffwechsels, der Zellfunktionen und der menschlichen Gesundheit beteiligt. Aus diesem Grund kann ein vielfältiger Nutzen in der Prävention und Therapie von Krankheiten erwartet werden.
Auf Spermidin treffen die bereits oben genannten Wirkungen der Polyamine zu. Hierbei verfügt Spermidin zudem über einige in der Fachliteratur gut beschriebene eigenständige Effekte, die über die allgemeinen Funktionen und Wirkmechanismen anderer Einzelsubstanzen aus der Gruppe der Polyamine hinausgehen. Diese spezifischen Wirkungen tragen u. a. dazu bei, dass Spermidin die Tumorentwicklung (Karzinogenese) vermindert und vor Krebs, Neurodegenerationen, metabolischen Krankheiten und Herzerkrankungen schützen kann.
Die allgemeinen Wirkungen von Spermidin (nach Madeo et al. [29]):
Spermidin …- fördert die Autophagie (Zellreinigungs- und Zellregenerationsprozess; Krankheitserreger und fehlgefaltete Proteine oder nicht mehr funktionelle Zellbestandteile werden abgebaut und verwertet).
- wirkt wie ein Kalorienrestriktions-Mimetikum (Nachahmung des lebensverlängernden Effektes bei einer reduzierten Energiezufuhr aus Lebensmitteln).
- verlängert die Lebensspanne.
- reduziert altersbedingte Gedächtnisstörungen.
- schützt Nervenzellen (Neuroprotektion).
- unterdrückt entzündungsfördernde Zytokine und moduliert so das Immun- und Entzündungssystem.
- verlangsamt die altersbedingte Degeneration von Stammzellen.
- verbessert diastolische Funktionen.
- reduziert die Versteifung/Steifheit von Arterienwänden, und wirkt somit auch einer Herzinsuffizienz entgegen.
- reduziert Knochenverlust, der aufgrund einer Entfernung der Eierstöcke eintreten kann (Ovarektomie; OVX).
- verbessert die Gestalt und Funktion der Nieren bei erhöhtem Blutdruck (zumindest in Tierexperimenten bei Ratten).
- reduziert altersbedingte und Bluthochdruck-bedingte Nierenschäden.
- trägt dazu bei, die normale Funktion synaptisch aktiver Zonen im Gehirn zu erhalten bzw. zu verbessern.
- schützt vor einer lebensbedrohlichen Sepsis („Blutvergiftung“).
- reduziert Myopathien („Muskelleiden“; Erkrankung der Muskulatur, die meist mit Muskelschwäche einhergeht).
- verbessert die Muskelfestigkeit.
- erzielt Blutdruck-senkende Effekte durch die Verbesserung der Bioverfügbarkeit von Arginin.
- reduziert die Karzinogenese und die krankhafte Vermehrung von Gewebe (Fibrose) in der Leber.
Spermidin aktiviert die Autophagie
Die so genannte Autophagie ist ein wichtiges Reinigungs- und Recycling-Programm des Körpers. Sie ist für die Homöostase und das Überleben unerlässlich. Die Autophagie unterstützt den Organismus und die Zellen dabei, Schlacken und „Schrott“ zu verdauen sowie fehlgeleitete, überflüssige oder falsch gebildete Zellbestandteile abzubauen und der Wiederverwertung zuzuführen. Sie ist wesentlich an der Erhaltung der Zellhomöostase beteiligt und ermöglicht den Zellen die Anpassung an molekulare Stresszustände. Des Weiteren liefert sie Energie und Material für die Bildung neuer zellulärer Strukturen.
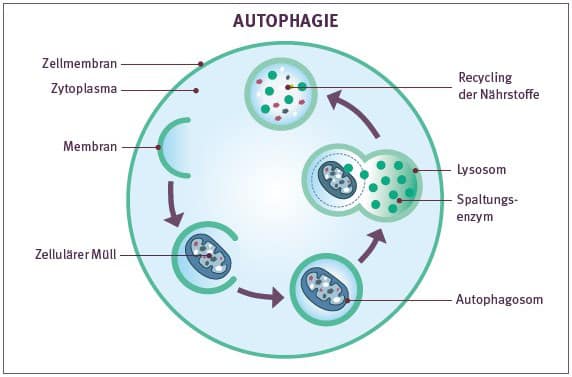
Eine gut funktionierende Autophagie übernimmt auch in Bezug auf pathologische Prozesse wichtige Aufgaben. Dazu zählen zum Beispiel die Verbesserung metabolischer Störungen und die Verhinderung neurodegenerativer Erkrankungen wie Multiple Sklerose, Morbus Parkinson oder Morbus Alzheimer durch die Beseitigung fehlgefalteter Proteine.
- durch Begrenzung der Kalorienzufuhr. — Dies kann durch Fasten oder eine dauerhafte niederkalorische Ernährung erreicht werden.
- durch den Einsatz sogenannter Kalorienrestriktions-Mimetika, welche die Effekte einer reduzierten Kalorienzufuhr (= Kalorienrestriktion) nachahmen. — Spermidin ist ein wichtiger Vertreter in der Gruppe der Kalorienrestriktions-Mimetika und wirkt ähnlich wie die sekundären Pflanzenstoffe Resveratrol aus Trauben und Epigallocatechingallat (EGCG) aus Grüntee.
Verlängert Spermidin die Lebensspanne?
Heutzutage gilt Spermidin als universelle Anti-Aging-Droge, da es zu den wenigen körpereigenen Stoffen gehört, die als Kalorienrestriktionsmimetika fungieren und so die Autophagie aktiv fördern [40]. Spermidin wirkt auch über andere Mechanismen: Es reguliert das Wachstum, die Neubildung von Zellen (Proliferation), den Zelltod (Apoptose) und moduliert die Protein-Translation sowie Genexpression. Des Weiteren hemmt es Entzündungen und die Entstehung von Fettzellen (Adipogenese) sowie die Histonacetylierung. Spermidin verbessert den Fettstoffwechsel.
Das Polyamin aktiviert den für das Zellwachstum und die Proteinsynthese essenziellen „Eukaryotic translation initiation factor 5A“ (eIF5A), welcher als Translations-Dehnungsfaktor gilt und an der Bildung von Peptidbindungen bei der Translation (Übersetzung genetischer Informationen) von mRNA beteiligt ist. eIF5A enthält als derzeit einzig bekanntes Protein eine besondere Aminosäure, welche durch die Desoxyhypusin-Synthase und die Desoxyhypusin-Hydroxylase gebildet wird und Spermidin als Substrat benötigt. Desoxyhypusin-Synthase ist ein Enzym mit dem systematischen Namen Lysin.
Spermidin reduzierte unter anderem bei Mäusen die Malondialdehyd-Spiegel (Abbauprodukt mehrfach ungesättigter Fettsäuren; wichtiger Biomarker für oxidativen Stress) im Gehirn und erhöhte die SOD-Aktivität (Superoxid-Dismutase; korreliert mit erhöhter Lebenserwartung). Spermidin verbessert außerdem die Funktion der Mitochondrien [19, 27, 36, 38, 48, 54, 58, 64].
Mittlerweile gilt es als gesichert, dass eine externe Spermidin-Zufuhr aufgrund der Autophagie-Aktivierung und der anderen typischen Polyamin-Effekte zumindest die Lebensspanne von Modell-Organismen wie Fruchtfliegen, Hefen und Würmern verlängert. Weiter stoppt es den altersbedingten Erinnerungsverlust bei Fruchtfliegen und verringert altersabhängige Proteinschäden bei Mäusen. Es reduziert auch altersbedingte Erkrankungen und den Verlust motorischer Fähigkeiten [19, 27, 36, 54]. So erweiterte Spermidin bspw. in einer von Gupta et al. durchgeführten Untersuchung die Lebensspanne von Fliegen, Hefen, Würmern und menschlichen Immunzellen. Es hemmt oxidativen Stress und das Absterben von Gewebe (Nekrose) bei alternden Mäusen. Es regt in älteren Hefen die Deacylierung von Histon H3 durch die Hemmung von Histon-Acyltransferasen an. Werden Polyamine aus dem Körper entfernt, führt dies zu einer übermäßigen Acetylierung, zu einem frühen Zelltod, zur Radikalbildung und zu einer verkürzten Lebensdauer. Spermidin kurbelt die Autophagie stark an, ist wichtig für die Unterdrückung der Nekrose und verlängert dadurch die Lebensspanne [8].
In präklinischen Modellstudien verlängerte die zusätzliche Gabe von Spermidin auch die Gesundheits- und Lebensspanne von Menschen. In einer prospektiven Kohortenstudie von Kiechl wird bestätigt, dass Spermidin die menschliche Lebensdauer verlängert. Die Gesamtmortalität sank in der Untersuchung pro Drittel zunehmender Spermidin-Einnahme von 40,5 (95% CI) auf 23,7 (95% CI) beziehungsweise 15,1 (95% CI), was einer kumulativen Mortalitäts-Inzidenz von 0,48, 0,41 beziehungsweise 0,38 entspricht. — Diese kumulative Mortalitäts-Inzidenz (CI) gibt an, wie wahrscheinlich es ist, dass eine Person innerhalb einer festgelegten Zeitspanne eine bestimmte Erkrankung entwickeln beziehungsweise sterben (Mortalitätsinzidenz) wird. Das Sterblichkeitsrisiko zwischen dem oberen und unteren Drittel der Spermidin-Zufuhr war ähnlich wie bei einem um 5,7 Jahre jüngeren Alter [8, 9, 20, 27, 31].
Spermidin schützt das Herz
Eine gestörte Autophagie kann sich schädlich auf das Herz-Kreislaufsystem auswirken. Demzufolge können Substanzen, die die Autophagie aktivieren, der Entstehung von Herz-Kreislauferkrankungen wie Arteriosklerose, Herzinsuffizienz, KHK (koronare Herzkrankheit), Herzrhythmusstörungen und diabetische Kardiomyopathie entgegenwirken. Spermidin stimuliert außerdem die mitochondriale Atmung und verbessert die mechano-elastische Funktion der Herzmuskelzellen (Kardiomyozyten) [42, 69].
Bei einer Herzinsuffizienz liegt ein Überschuss des Enzyms PP5 (Serin/Threonin-Protein Phosphatase 5) vor. Dieses Enzym lagert sich an der Herzkammer an, wodurch deren Dehnbarkeit verringert und die Elastizität des Herzens eingeschränkt wird. Spermidin kann PP5 effektiv hemmen. Mäuse, die mit Spermidin gefüttert wurden, hatten im Alter noch ein gesundes Herz. Auch bei Menschen, die sich spermidinreich ernähren, treten seltener Herz-Kreislauferkrankungen auf. Da der Spermidin-Spiegel im Alter abnimmt, könnte eine Supplementation sinnvoll sein [9, 57].
Die gesundheitlichen Effekte von Spermidin auf das Herz-Kreislaufsystem konnten in zahlreichen Versuchen mit Ratten und Mäusen belegt sowie auf den menschlichen Organismus übertragen werden:
- Eine Supplementation mit Spermidin aktiviert die Bildung neuer Mitochondrien in der Zelle (mitochondriale Biogenese) durch die SIRT1-vermittelte Deacetylierung von PGC-1alpha (Protein). Zudem hemmt Spermidin mitochondriale Funktionsstörungen und bewahrt die Ultrastruktur der Herzmuskulatur. Bei den Tieren waren außerdem die Ornithindecarboxylase (ODC) und SIRT1/PGC-1a (der Sirtuin-1/Peroxisom-Proliferator-aktivierte Rezeptor-Gamma-Coaktivator-Alpha-Signalweg), welcher die mitochondriale Biogenese reguliert, herabgeregelt. Die SPD/Spermin-N1-Acetyltransferase war hingegen hochgeregelt. Spermidin erhöhte in den Versuchen PGC-1a, SIRT1, NRF1, NRF2, TFAM (mitochondrialer Transkriptionsfaktor a) und die OXPHOS-Leistung (oxidative Phosphorylierung) der Herzmuskelzellen [62].
- Eine Nahrungsergänzung mit Spermidin dämmt das Risiko einer Aussackung der Gefäßwände der Arterien im Bauch (abdominale Arterienaneurysmen) ein und verbessert die Integrität (Unversehrtheit) der Aortenstruktur. Spermidin erhöht die von der Autophagie abhängigen Eiweiße und reduziert das Eindringen entzündlicher Substanzen (inflammatorische Infiltration) sowie entzündlicher Fresszellen (Monozyten). Demzufolge könnte Spermidin eine vielversprechende Therapie bei abdominalen Aortenaneurysmen sein [25].
- Eine Spermidin-Supplementation verbessert die Funktion der Herzmuskelzellen (Kardiomyozyten) und reduziert die „außerplanmäßige” Nekrose (d. h. ein verfrühtes Absterben) von Herzmuskelzellen. Nach einem Infarkt steigert Spermidin die Herzfunktion und mindert die Infarktgröße sowie die Zunahme der Herzmuskelmasse (myokardiale Hypertrophie). Weiter reduziert es Entzündungen, oxidative Schäden und die Apoptose (programmierter Zelltod) sowohl in vitro („im Reagenzglas durchgeführt“) als auch in vivo („am lebenden Objekt beobachtet/durchgeführt“) [65].
- Die zusätzliche Gabe von Spermidin verlangsamt die Arterienalterung, welche durch reduziertes Stickstoffmonoxid, erhöhte AGEs (Advanced Glycation Endproducts), Superoxide und anderen oxidativen Stress ausgelöst wird. Spermidin normalisiert die Arterien-Pulswellen-Geschwindigkeit (aPWV; direktes Maß für die Arteriensteifheit), repariert die Endothel-abhängige Arteriendilatation (EDD = enddiastolischer Durchmesser; Durchmesser der Herzhöhlen am Ende der Diastole) und verringert oxidativen Stress, AGEs sowie Superoxid. Diese Untersuchung lässt vermuten, dass Spermidin Behandlungen gegen arterielles Altern sowie Maßnahmen zur Vorbeugung altersbegleitender Herzkrankheiten verbessern könnte [22].
- Spermidin hemmt signifikant die Lipid-Akkumulation („Fettanreicherung“) und die nekrotische Kernbildung in arteriosklerotischen Plaques. Die Lipid-Akkumulation nimmt ab, da Spermidin den Cholesterin-Efflux durch die Aktivierung der Autophagie stimuliert. Die Größe und Zusammensetzung der Ablagerungen (Plaques) ändert sich durch Spermidin nicht. Die Stimulation der Autophagie könnte die Entstehung von Gefäßkrankheiten verhindern [35].
- Erleidet ein Kind im Mutterleib einen gefährlichen Sauerstoffmangel (Intrauterine Hypoxie), dann führt dies zu einer Abnahme der kardialen Ornithindecarboxylase und zu einer gesteigerten Bildung der Spermidin-/Spermin-N1-Acetyltranferase. Es kommt zu einer Verringerung des Körpergewichts, Herzgewichts, der Herzmuskelzellenproliferation, der antioxidativen Kapazität, der Mitochondrienstruktur und der Mitochondrien-Biogenese. Parallel dazu sterben mehr Herzmuskelzellen ab und es kommt zu einer krankhaften Vermehrung des Gewebes (Fibrose). Diese Schäden können durch eine Spermidin-Supplementation in die Plazenta vermieden werden [5].
- Eine gesteigerte Autophagie schützt vor kardiovaskulären Erkrankungen. Bei Ratten und Mäusen entfaltete diätetisches Spermidin durch die Erhöhung der Herzautophagie und Mitophagie (Abbau von Mitochondrien) herzschützende Effekte. Zudem bremst Spermidin durch die Verbesserung der Arginin-Bioverfügbarkeit und den Schutz der Nieren die Entwicklung von Bluthochdruck (Hypertonie). Bei Menschen zeigte sich ein Zusammenhang zwischen der Spermidin-Supplementierung und einem reduzierten Blutdruck sowie einem verringerten Risiko für die Entstehung von kardiovaskulären Erkrankungen. Erniedrigt war auch das Risiko, an den Folgen dieser Erkrankungen zu sterben. Spermidin ist ein Herz- und Blutgefäße-schützender Autophagie-Aktivator [10].
- Spermidin erhöht bei Mäusen die Lebensdauer und zeigt herzschützende Effekte. Es reduziert eine krankhafte Herzmuskelvergrößerung, senkt den systolischen Blutdruck und erhält die diastolische Funktion bei älteren Tieren aufrecht. Die Gabe von Spermidin als Nahrungsergänzung erhöht die Autophagie des Herzens, die Mitophagie sowie die mitochondriale Atmung. Es verbessert die mechano-elastischen Fähigkeiten der Herzmuskelzellen, erhöht die Titin-Phosphorylierung und unterdrückt leichte Entzündungen. Beim Menschen wurde ein Zusammenhang zwischen einem hohen Spermidin-Gehalt in der Nahrung und einem verringerten Blutdruck sowie einem geringeren Auftreten von Herz-Kreislauf-Erkrankungen beobachtet [9].
Die Effekte des Spermidins auf das Herz-Kreislaufsystem wurden mittlerweile auch mit einer wachsenden Menge an Humandaten verifiziert.
- Laut aktueller Aussagen der Weltgesundheitsorganisation (WHO) und IMF existiert eine negative Assoziation zwischen der Spermidin-Zufuhr aus der Nahrung und der Sterberate an kardiovaskulären Erkrankungen [57].
- Tong und Madeo beschreiben, dass Spermidin in epidemiologischen Studien eine schützende Wirkung auf die kardiovaskuläre Gesundheit hat. Weiter schrieben sie, dass eine spermidinreiche Ernährung die mit kardiovaskulären Erkrankungen (und auch mit Krebs) verknüpfte Gesamtsterberate verringert [30, 60].
- Laut Nilsson wirkt Spermidin sowohl bei Mäusen als auch Menschen herzschützend [42[.
- In einer Studie von Matsjumoto verbesserten erhöhte Spermidin-Spiegel die endothelialen Funktionen bei gesunden Probanden und reduzierten das Risiko für Arteriosklerose [33].
- Eisenberg berichtet in einer weiteren Studie [9], dass Spermidin alterungsbedingte Herzfunktionsstörungen bei Mäusen durch die Aktivierung der Autophagie rückgängig macht. Spermidin „verjüngt“ die quergestreifte Muskulatur und verbessert mitochondriale Funktionen sowie Schlüsselfunktionen im Zusammenhang mit der Herzalterung (einschließlich Bluthochdruck, linksventrikuläre Hypertrophie, diastolische Dysfunktion und erhöhte linksventrikuläre Steifheit). Zudem wirkt es antientzündlich. Die Effekte sind von der Autophagie abhängig.
Spermidin und seine Auswirkungen auf das Gehirn
Spermidin spielt eine wichtige Rolle bei der Entwicklung des Gehirns. Auch die Funktionsfähigkeit des Gehirns, einschließlich des Erwerbs und der laufenden „Konsolisierung” verschiedenster Gedächtnis-Funktionen (Verfeinerung und Festigung von Erinnerungen oder Lerninhalten im Langzeitgedächtnis) sind von Spermidin abhängig. Aktuelle Untersuchungen deuten darauf hin, dass vor allem die Autophagie-Effekte und die Polyamin-Bindungsstellen am NMDA-Rezeptor (NMDAr) für die Auswirkungen von Spermidin auf das Gedächtnis verantwortlich sind.
Die Effekte auf das Gehirn wurden zunächst im Tiermodell bei Ratten und Taufliegen nachgewiesen. Inzwischen existieren auch erste Humanstudien, welche die darin gefundenen Effekte bestätigen.
- Die Verabreichung von Spermidin verbesserte bei Ratten die Konsolidierung des Angstgedächtnisses, wobei sowohl der TrkB-Antagonist (das Protein Tyrosinrezeptorkinase B) ANA-12 als auch der Pl3K-Inhibitor (das Enzym Phosphoinositid-3-Kinase) LY294002 die Wirkung von Spermidin auf das Gedächtnis verhinderte. Dies deutet darauf hin, dass die durch Spermidin verbesserte Gedächtniskonsolidierung die Aktivierung des TrkB-Rezeptors und des PI3K/Akt- Signalwegs beinhaltet [2].
- Die Spermidin-Gabe schützt Taufliegen (genauer: Drosophila) vor altersbedingten Gedächtnisstörungen. Das Nahrungsergänzungsmittel arbeitet direkt an den Synapsen und erlaubt dort eine von der Autophagie abhängige homöostatische Regulation des Teils der Synapse, von welchem die Erregung ausgeht [3].
- Im Alter nehmen die Polyamine im Gehirn ab. Bei Fruchtfliegen wurde beobachtet, dass die Abnahme der Polyamine auch mit einer nachlassenden Gedächtnisleistung einhergeht. Die zusätzliche Gabe von Spermidin verbessert die Autophagie, stellt einen jugendlichen Spermidin-Spiegel wieder her und blockiert den Gedächtnisverlust. Eine Besserung der Gedächtnisstörungen tritt jedoch nicht ein, wenn genetische Defizite die Autophagie verhindern oder einschränken [17].
- In einer aktuellen Arbeit aus dem Jahre 2020 bestätigt Gosh, dass Spermidin die Langlebigkeit fördert und die Autophagie anregt. Es erhält die zelluläre und neuronale Homöostase aufrecht. Spermidin und Spermin interagieren mit dem Opioidsystem und beeinflussen die Neuroinflammation (Entzündung von Nervengewebe). Weiter hemmen sie den Calcium-Einstrom in die Zellen, schädliche Radikale und die Glutamat-Exzitotoxizität. Die Entwicklung und Funktion des Gehirns ist abhängig von der Polyamin- und insbesondere von der Spermidin-Konzentration. Des Weiteren führen altersbedingte Schwankungen des Spermidin-Spiegels zu Ungleichgewichten im neuralen Netzwerk und gefährden die Neurogenese (Bildung von Nervenzellen). Eine zusätzliche Spermidin-Zufuhr unterstützt demzufolge die Behandlung von Gehirnerkrankungen, wobei die genauen Mechanismen noch nicht vollständig bekannt sind [16].
- Huang hat herausgefunden, dass die Gabe von Spermidin nach Schädel-Hirn-Traumata (kurz: SHT oder engl. TBI = traumatic brain injury) signifikant den neurologischen NNS-Score beschleunigt und die Latenz im Morris-Water-Maze-Test (auch: Morris-Wasserlabyrinth) verkürzt. In Studien zeigte sich durch Spermidin eine verbesserte Bluthirnschrankenfunktion. Darüber hinaus kam es zu positiven Veränderungen bezüglich des Zelltodes und bei Gehirnödemen. Entzündungsfördernde Zytokine und TBI-Marker waren signifikant erniedrigt. Da bei TBI-Patienten mit schweren Störungen die Spermidin-Spiegel signifikant erniedrigt waren, könnte das Nahrungsergänzungsmittel laut Huang als neue Therapieform bei Schädel-Hirn-Traumata eingesetzt werden [18].
- In einer randomisierten preSmartAge-Studie, die von Dr. Miranka Wirth an der Charité durchgeführt wurde, verbesserte Spermidin die Gedächtnisleistung deutlich. Aus der Studie geht hervor, dass der Effekt auf der Stimulation neuro-modulatorischer Aktionen im Gedächtnissystem beruht [63].
Spermidin zum Schutz vor neurodegenerativen Erkrankungen?
Ergänzend zu den bisher beschriebenen Wirkungen von Spermidin auf das Gehirn werden im Folgenden die Effekte auf neurodegenerative Störungen vorgestellt und mit neuen Erkenntnissen aus Humanstudien untermauert:
- Dem Forscher M. Fischer ist es in einer kleinen Studie der Nachweis gelungen, dass eine erhöhte Autophagie in den Gehirnzellen das Gedächtnis verbessert. Des Weiteren fand er heraus, dass T-Zellen und Zytokine als wichtige Mediatoren in der Pathologie von Morbus Alzheimer agieren. In hohen Dosierungen regelt Spermidin alle Zytokine außer IL-17A herab, fördert die Autophagie und erhöht die T-Zellaktivierung [13].
- Pekar stellte in seiner Untersuchung fest, dass Spermidin aufgrund seines Einflusses auf die Autophagie die Beseitigung von Amyloid-Beta-Plaques triggert. Es wirkt sich positiv auf Demenz aus und führt bei Altenheimbewohnern bereits nach dreimonatiger Einnahme zu einer deutlichen Verbesserung der kognitiven Leistungsfähigkeit [50].
- Im Jahre 2020 beschrieb Schwarz, dass eine höhere Spermidin-Zufuhr bei älteren Menschen mit einem größeren Volumen des Hippocampus verknüpft ist. Außerdem stellte er eine größere mittlere Kortexdichte und eine gesteigerte Kortexdicke in für Alzheimer anfälligen Gehirnbereichen sowie in denen zum Scheitelbein und zu den Schläfen gehörenden Gehirnanteilen fest [56].
- Bereits in einer früheren randomisierten Untersuchung aus dem Jahre 2018 hat Schwarz herausgefunden, dass Spermidin vor kognitiven Defiziten und Neurodegenerationen schützen kann [55].
Auch die Deutsche Gesellschaft für Neurologie hat inzwischen das große Potenzial von Spermidin hinsichtlich seiner Schutzwirkung in Bezug auf Demenz anerkannt und schreibt, dass bisherige Daten vermuten lassen, dass sich Spermidin positiv auf die Gehirnfunktionen und auf die geistigen Fähigkeiten auswirkt. Diese Wirkungen stehen aktuell im Fokus der SmartAge-Studie, welche unter der Leitung von Frau Prof. Flöel durchgeführt wird. Hierbei kommen mit Spermidin angereicherte Weizenkeimpräparate zum Einsatz [80, 81].
Einsatz von Spermidin in der Onkologie
Spermidin werden mittlerweile auch positive Effekte im Bereich der Krebsprävention nachgesagt. Eventuell kann das Polyamin sogar bei kleinen Tumoren, die sich in einem frühen Stadium befinden, behilflich sein. Entsprechende Untersuchungen lieferten u. a. folgende Resultate:
- Levesque nutzte Spermidin in einer seiner Studie als Antikrebsmittel. Eine Kombination aus Kalorienrestriktions-Mimetika (CRM; z. B. Spermidin) mit Aktivatoren des immunogenen Zelltods (ICD) und Immun-Checkpoint-Inhibitoren (ICI) verbesserte bei Mäusen die Kontrolle über das Tumorwachstum. Ohne die zusätzliche Gabe solcher Spermidin-haltigen Kalorienrestriktions-Mimetika bewirken ICDs und ICIs hingegen „nur” eine partielle Sensibilisierung für die Behandlung [71].
- Wie Yue und Kollegen entdeckten, kann Spermidin durch die aktivierte Autophagie Krebszelldefekte, welche den oxidativen, stressbedingten Zelltod auslösen und Leberkarzinome sowie Leberfibrose fördern, reduzieren. Als Nahrungsergänzungsmittel kann das Polyamin nicht nur die Lebensspanne von Mäusen um bis zu 25 Prozent verlängern, sondern auch Leberfibrose und Leber-Karzinom-Herde minimieren [66].
- Aus einer Übersichtsarbeit von Fan und Kollegen geht hervor, dass Spermidin Onkogene („Krebsgene“), die Autophagie, Immunität und Apoptose in Zusammenhang mit Krebs beeinflusst. Anscheinend hat eine Nahrungsergänzung mit Spermidin jedoch einen Doppeleffekt: Es unterdrückt die Tumorgenese, reduziert die Krebsmortalität aufgrund seiner Wirkung als Kalorienrestriktionsmimetikum und verlängert die Lebensspanne von Krebspatienten im frühen Stadium der Erkrankung. Jedoch könnte es aber auch im fortgeschrittenen Krebsstadium das Wachstum größerer Tumore beschleunigen [11].
- Pietrocola äußerte sich im Jahre 2019 zur prospektiven Studie von Kiechl [20], aus welcher hervorgeht, dass Spermidin die Krebsmortalität senkt, und schrieb, dass Krebs erst entstehen kann, wenn das Immunsystem die Gefahr nicht erkennt und bösartige Zellen nicht eliminiert. Die durch Spermidin aktivierte Autophagie ist demnach in der Lage, bösartige Veränderungen zu unterdrücken, prokarzinogene entzündliche Reaktionen zu hemmen und die Antitumor-Immunität zu fördern [51].
- In einer prospektiven Studie von Vargas, an der über 87000 Frauen teilnahmen, wurde eine höhere Polyamin-Zufuhr pro Tag mit einem reduzierten Risiko für kolorektalen Krebs (HR = durchschnittlich 0,81), insbesondere bei übergewichtigen Frauen, in Verbindung gebracht [61]. — Hierbei ist jedoch zusätzlich erwähnenswert, dass sowohl Krebszellen mit einer erhöhten Stoffwechselaktivität als auch gesunde Zellen Polyamine nutzen. Aus diesem Grund wird aktuell diskutiert, ob eine Dysregulation des Polyamin-Stoffwechsels Krebs fördern könnte. Die gesamte Polyamin-Konzentration ist dabei erhöht, und die Enzyme aus dem Polyamin-Stoffwechsel wie Adenosylmethionin-Decarboxylase (SAMDC) und Sperminoxidase (SMO) sind hochaktiv. Sollte sich dies bewahrheiten, sollten hohe Polyamin-Spiegel während der Krebstherapie vermieden beziehungsweise gesenkt werden [72–79].
Virusinfektionen: Neuer Präventions- und Therapieansatz?
In einer aktuellen Studie von Gassen aus dem Jahre 2020, an der auch Prof. Drosten beteiligt war, zeigte sich, dass durch eine Infektion mit SARS-CoV-2 das zelleigene Spermidin aus dem Körper entfernt wird. Auch die Autophagie wird durch die Infektion gehemmt. Die Verabreichung von Spermidin konnte in Zellkulturen die Verbreitung des SARS-CoV-2 um 85 Prozent reduzieren [14].
Als versuchsweise gesunde Zellen mit Spermidin behandelt wurden, sank die Infektionsrate um 70 Prozent. Spermidin könnte somit eine große Rolle in der Prävention und Behandlung von Corona/COVID-19 sowie anderen Virusinfektionen spielen. Diese Ergebnisse bzw. Vermutungen müssen jedoch noch in weiteren Humanstudien überprüft werden, da noch unklar ist, ob die in diesen oder anderen Studien verwendeten Dosierungen beim Menschen die gleichen Wirkungen erreichen.
Weitere Effekte von Spermidin
Neben den o. g. Einsatzmöglichkeiten wurde bzw. wird das Polyamin Spermidin auch mit den nachfolgend genannten gesundheitliche Wirkungen in Verbindung gebracht:
- Bei Mäusen vermindert Spermidin die Entwicklung von Symptomen, die an Psoriasis (Schuppenflechte) erinnern. Es hemmt Entzündungen und beeinflusst die metabolische Fitness von dendritischen Zellen (Abwehrzellen des Immunsystems). Der Wissenschaftler Li kam daher am Ende seiner Untersuchungen zu dem Ergebnis, dass Spermidin ein vielversprechendes Therapeutikum für Menschen mit Autoimmunerkrankungen sein könnte [24].
- Bei einem Niereninfarkt wird das Nierengewebe aufgrund eines Gefäßverschlusses unzureichend durchblutet und geht zugrunde. Sobald der Blutfluss nach diesem Ereignis wiederhergestellt wurde, können sogenannte Reperfusions-Verletzungen auftreten. Der Niereninfarkt (Nierenischämie) und die darauf folgenden Verletzungen führen aufgrund des enormen oxidativen Stresses zu einer hohen Sterberate. Ein entsprechender Artikel von J. Kim beschreibt, dass Spermidin Hefezellen vor dem Altern schützt, indem es oxidativen Stress und Nekrose hemmt. Es reduziert außerdem erhöhte Kreatinin-Spiegel und mindert Verletzungen der Nierentubuli („Harnkanälchen“) nach einem Niereninfarkt oder nach oxidativem Stress. Spermidin unterdrückt die Zerstörung der Plasmazellmembranen und die Nekrose [21].
- Mit dem Alter lässt die Autophagie nach, was zur Entstehung von Arthrose beitragen kann. Da gleichzeitig altersbedingt auch der Spermidin-Gehalt abnimmt, werden Störungen der Autophagie verstärkt. Dies kann zu reduzierten Zellfunktionen und zu verminderter Gen- sowie Protein-Expression führen. Die Zufuhr von Spermidin aktiviert laut Pradeep die Autophagie der Knorpelzellen (Chondrozyten) und schützt möglicherweise vor der Entwicklung von Arthrosen [70].
- Farhadian hat festgestellt, dass Spermidin durch die Bildung eines Spermidin-a-Chymotrypsin-Komplexes die Aktivität, Stabilität und Absorption von a-Chymotrypsin (Eiweiß abbauendes Pankreasenzym) verbessert [12].
Zwischenfazit zu den Wirkungen von Spermin und Spermidin
Spermin ist ein wichtiger Spermidin-Metabolit und verfügt über besondere eigenständige Wirkungen. Pegg beschreibt in einer Übersichtsarbeit, dass das Polyamin Spermin vor Stress schützt, den Flow durch K-Kanäle unterstützt, die Aktivität der Gehirn-Glutamatrezeptoren kontrolliert und oxidative Schäden sowie Radikale minimiert. Demzufolge ist es am Lernen und an der Gedächtnisleistung beteiligt und beeinflusst die Wachstumsantwort [48, 49].
Es fördert die Stabilisierung der Helixstruktur von Nukleinsäuren und die Gestaltung von glykierten Proteinen wie Histonen. Spermin moduliert den Calcium-Transport, aktiviert die Adenylatcyclase (katalysiert die Bildung von zyklischem Adenosinmonophosphat cAMP) sowie die H+-ATPasen (wichtig für den Auf- und Abbau von ATP, den Energiestoffwechsel sowie die Signaltransduktion) und ist an der Umwandlung des Coenzyms A beteiligt.
Darüber hinaus dient Spermin als Reservoir für freies Spermidin. Ist die Spermin-Bildung eingeschränkt, führt dies zu neurologischen Veränderungen, Störungen der Intelligenz, niedrigem Blutdruck und reduziertem Muskel- sowie Knochenwachstum [49, 54].
Wheat Germ: Weizenkeime und ihre Inhaltsstoffe
Weizenkeime enthalten hohe Mengen an Spermidin. In Studien werden meist mit Spermidin und Polyaminen angereicherte Weizenkeimextrakte verwendet, welche inzwischen auch als Nahrungsergänzungsmittel angeboten werden. Es lohnt sich deshalb, einen genauen Blick auf die eventuellen gesundheitlichen Effekte der Weizenkeime zu werfen.
Weizenkeime enthalten ölhaltige Bestandteile voll ausgereifer Weizenkörner und machen ungefähr 3 Prozent von deren Gesamtgewicht aus. Aus den Weizenkeimen entwickelt sich zunächst das wertvolle Weizengras, aus welchem sich später weitere Weizenkörner als Saat bilden. Bei der Herstellung von Weizenmehl fallen Weizenkeime meist als Nebenprodukt an. Sie besitzen eine hohe Nährstoffdichte und sind reich an Mikronährstoffen sowie Ballaststoffen (1,5 bis 4,5 Prozent). Der Öl-Gehalt liegt bei ca. 10 Prozent, wobei viele ungesättigte Fettsäuren enthalten sind. Der Eiweißanteil beträgt durchschnittlich 27 Prozent, je nach Herkunft sind aber auch zwischen 13 und 35 Prozent möglich.
Entölte Weizenkeime enthalten 50 bis 90 Prozent weniger Lipide. Aus ihnen werden Weizenkeim-Öl und Weizenkeim-Extrakte hergestellt. Im entölten Extrakt stecken nicht nur weniger Fettsäuren, sondern auch weniger fettlösliche Carotinoide sowie ein niedrigerer Gehalt an Vitamin E [85, 91, 100]. Während in nativen Weizenkeimen die Mengen der Inhaltsstoffe schwanken, sind sie in Weizenkeim-Extrakten weitestgehend standardisiert.
- Vitamine (B1, B2, B3, B5, B6, B9 sowie die Vitamine A, K und E);
- Mineralstoffe und Spurenelemente (Calcium, Magnesium, Eisen, Kalium, Jod, Chrom, Mangan, Zink, Molybdän, Schwefel und Phosphor);
- Polyamine (Spermin, Spermidin und Putrescin);
- Fettsäuren (insbesondere a-Linolensäure, Linolsäure, Ölsäure und Palmitoleinsäure);
- Aminosäuren (wie Arginin, Tryptophan, Lysin, Methionin, Phenylalanin, Leucin und Isoleucin);
- Sekundäre Pflanzenstoffe (Carotinoide, Polyphenole und Flavonoide);
- und auch Polyamine wie Spermin, Spermidin und Putrescin.
Die Wirkungen der Weizenkeime
Die oben genannten Inhaltsstoffe weisen auf ein großes gesundheitliches Potenzial hin. Bislang wurden die Wirkungen der Weizenkeime jedoch erst teilweise experimentell erforscht, und wirklich umfassende Humanstudien gibt es kaum. Das große Erfahrungswissen über den kombinierten Nutzen der einzelnen Inhaltsstoffe und deren Bedeutungen für den Stoffwechsel sowie für die allgemeine Gesundheit lässt aber Aussagen über die Gesamtwirkung der Weizenkeime zu. Die dahin gehende Forschung nennt auch eine ganze Reihe möglicher medizinischer Einsatzgebiete, darunter u. a. folgende:
- Weizenkeim-Extrakte verfügen aufgrund ihres hohen Mikronährstoff-Gehalts über antientzündliche, antioxidative, antibakterielle und immunmodulierende Effekte [91].
- Laut einer Humanstudie von Ataollahi mindern Weizenkeime die verschiedenen Beschwerden, die beim prämenstruellen Syndrom (PMS) auftreten. Laut Balint wirkt sich fermentierter Weizenkeimextrakt als Ergänzung zur Corticoidtherapie positiv auf rheumatoide Arthritis aus und verbessert die Beschwerden sowie Lebensqualität [82, 83].
- Weizenkeime verbessern die Funktion des Magen-Darm-Traktes. Sie reduzieren entzündungsfördernde Zytokine im Darm, erhöhen den Anteil an Buturat (Buttersäure) sowie Propionsäure und regulieren dadurch die Zusammensetzung der Darmflora. Desweiteren erhöhen sie den Anteil an Laktobazillen und — wie sich in einer kleinen Doppelblindstudie von Moreira-Rosario herausstellte — auch die Menge an probiotisch nützlichen Bacteroides und Bifido-Bakterien [94, 96].
- In einer Doppelblindstudie von Mohammadi reduzieren Weizenkeime bei Typ-2-Diabetes den Cholesterinspiegel und steigern die antioxidative Kapazität. Ostlund schreibt ebenfalls, dass Weizenkeime die Cholesterin-Absorption im Darm hemmen. Laut Ojo minimieren Weizenkeime bei übergewichtigen Mäusen unter anderem das viszerale Fett, kardiale mitochondriale Dysfunktionen, das Serum-Insulin und die Insulinresistenz [93, 97, 98].
- Auch die Onkologie (Krebsforschung) zeigt Interesse am Weizenkeimextrakt, da sich dieser aus vielen biologisch aktiven Stoffen (einschließlich Benzoquinonen) zusammensetzt. In etlichen experimentellen Untersuchungen, kleinen Humanstudien und Tierstudien wurden für alkoholische und fermentierte Weizenkeim-Extrakte krebspräventive Effekte nachgewiesen, zum Beispiel bei Darmkrebs. Desweiteren wurden Wirkungen als komplementäre Maßnahme bei der Behandlung von verschiedenen Karzinom-Arten (Melanome, Lungenkrebs, Leukämie, Brustkrebs, kolorektales Karzinom) attestiert. Therapiebedingte Nebenwirkungen wie die Verminderung der neutrophilen Granulozyten im Blut oder wie Müdigkeits-/Erschöpfungs-Zustände verbesserten sich. Abgesehen davon konnten auch die Überlebenszeit verlängert und die Lebensqualität gesteigert werden. Insgesamt zeigte der therapiebegleitende Einsatz von Weizenkeim-Extrakten antimetastasierende, antiproliferative, die Tumorzellapoptose fördernde Wirkungen und unterstützt die Zytotoxizität natürlicher Killerzellen [84, 86–90, 92, 95, 99].
Desweiteren verbessern Weizenkeime sehr wahrscheinlich die Funktion und Leistungsfähigkeit des antioxidativen Netzwerks, der Mitochondrien, des Verdauungstraktes sowie des Entzündungs- und Immunsystems. Darüber hinaus beeinflussen sie auch das prämenstruelle Syndrom, den Fettstoffwechsel, Diabetes sowie Rheuma positiv und können auch in der Prävention sowie Behandlung von Krebs zum Einsatz kommen. Weizenkeime unterstützen die Wirkungen von Spermidin hervorragend.
Spermidin und Polyamine aus Weizenkeim-Extrakten: Dosierung und Einsatzgebiete
Durchschnittlich nehmen wir täglich rund 12 Milligramm Spermidin und andere Polyamine über die Nahrung auf, wobei die Menge stark von den persönlichen Essgewohnheiten abhängt. Polyamine können von den Darmbakterien auch selbst gebildet oder anderweitig vom Körper synthetisiert werden. — Dies funktioniert jedoch nur dann, wenn die Absorption im Darm uneingeschränkt abläuft, die Zusammensetzung der Darmflora stimmt, alle Stoffwechselprozesse normal verlaufen und die Grundbausteine sowie Cofaktoren für die Synthese in ausreichender Menge vorliegen.
Wenn allerdings diese Voraussetzungen nicht erfüllt sind, oder wenn ein erhöhter Bedarf insbesondere an Spermidin vorliegt (beispielsweise im Rahmen einer Krankheitsbehandlung oder im Zuge besonderer Maßnahmen zur Prävention oder Gesundheitsförderung), dann kann nach aktuellem Wissensstand die gezielte Einnahme von Spermidin oder hochwertigen Weizenkeim-Extrakten empfehlenswert sein. Standardisiert angereicherte Präparate eignen sich hierfür besonders.
Für Weizenkeim-Extrakte ergeben sich die folgenden Einsatzgebiete:
1.) zur Optimierung und Sicherung der Basisversorgung mit essenziellen Polyaminen, zum Beispiel bei:
- Diäten
- einseitiger Ernährung
- Stoffwechselstörungen
- chronischen Erkrankungen
- Schadstoff- und Stressbelastungen
2.) zur Krankheitsprävention, zum Beispiel von:
- neurologischen,
- neurodegenerativen,
- altersbegleitenden sowie
- kardiovaskulären Erkrankungen,
- und eventuell auch zur Vorsorge bei erhöhtem Krebsrisiko.
Um von den gesundheitsfördernden Effekten profitieren zu können, muss das Präparat ausreichend dosiert werden. Aktuell sind unter anderem Nahrungsergänzungsmittel mit 100 Milligramm Weizenkeimen und mit bis zu 5 Prozent Polyaminen sowie 2 Prozent Spermidin erhältlich. Ähnliche Präparate wurden bislang auch in Studien verwendet. Auf diese Weise können pro Tag 2 Milligramm Spermidin und 5 Milligramm Polyamine aufgenommen werden. Diese Menge gilt als gut verträglich und entspricht aktuellen Empfehlungen [55].
Zusammenfassung
Polyamine sind essenziell und übernehmen unzählige Aufgaben im gesamten Stoffwechsel sowie in der Entwicklung des Menschen. Sie werden einerseits über die Nahrung aufgenommen und andererseits vom Körper selbst produziert. In Weizenkeimen liegen Polyamine in hohen Konzentrationen vor, weshalb diese auch als Grundlage für polyaminreiche Nahrungsergänzungsmittel genutzt werden.
Weizenkeime besitzen eigenständige gesundheitsfördernde Eigenschaften und unterstützen die Wirkungen der Polyamine. In Situationen, in denen die Polyamin-Versorgung nicht sichergestellt werden kann, können qualitativ hochwertige standardisierte Präparate auf Weizenkeimbasis eingenommen werden.
Anhang A: Quellenangaben
A.1) Quellen zum Thema Polyamine
- Ali MA et al. (2011): Polyamines in foods: development of a food database. Food Nutr Res 2011;55:5572. [doi: 10.3402/fnr.v55i0.5572] [PubMed: 21249159]
- Beck Fabbrin SB et al. (2020): Spermidine-induced improvement of memory consolidation involves PI3K/Akt signaling pathway. Brain Res Bull 2020;164:208-213. [doi: 10.1016/j.brainresbull.2020.08.018] [PubMed: 32858125]
- Bhukel A et al. (2017): Spermidine boosts autophagy to protect from synapse aging. Autophagy 2017;13(2):444–445. [doi: 10.1080/15548627.2016.1265193] [PubMed: 28026976]
- Calandra RS et al. (1996): Polyamines in the male reproductive system. Acta Physiol Pharmacol Ther Latinoam 1996;46(4):209-222. [PubMed: 9222386]
- Chai N et al. (2019): Spermidine Prevents Heart Injury in Neonatal Rats Exposed to Intrauterine Hypoxia by Inhibiting Oxidative Stress and Mitochondrial Fragmentation. Oxid Med Cell Longev 2019:5406468. [doi: 10.1155/2019/5406468] [PubMed: 31217839]
- Dudley HW et al. (1926): The Chemical Constitution of Spermine Structure and Synthesis. Biochem J 1926;20(5):1082-1094. [doi: 10.1042/bj0201082] [PubMed: 16743746]
- Dudley HW et al. (1927): The Constitution and Synthesis of Spermidine, a Newly Discovered Base Isolated from Animal Tissues. Biochem J 1927;21(1):97–103. [doi: 10.1042/bj0210097] [PubMed: 16743828]
- Eisenberg T et al. (2009): Induction of autophagy by spermidine promotes longevity. Nat Cell Biol 2009;11(11):1305-1314. [doi: 10.1038/ncb1975] [PubMed: 19801973]
- Eisenberg T et al. (2016): Cardioprotection and lifespan extension by the natural polyamine spermidine. Nat Med 2016;22(12):1428-1438. [doi: 10.1038/nm.4222] [PubMed: 27841876]
- Eisenberg T et al. (2017): Dietary spermidine for lowering high blood pressure. Autophagy 2017;13(4):767-769. [doi: 10.1080/15548627.2017.1280225] [PubMed: 28118075]
- Fan J et al. (2020): Spermidine as a target for cancer therapy. Pharmacological Research 2020;159:104943. [doi: 10.1016/j.phrs.2020.104943] [PubMed: 32461185]
- Farhadian S et al. (2016): Molecular aspects of the interaction of spermidine and a-chymotrypsin. Int J Biol Macromol 2016;92:523-532. [doi: 10.1016/j.ijbiomac.2016.07.069] [PubMed: 27456119]
- Fischer M et al. (2020): Spermine and spermidine modulate T-cell function in older adults with and without cognitive decline ex vivo. Aging (Albany NY) 2020;12(13):13716–39. [doi: 10.18632/aging.103527] [PubMed: 32603310]
- Gassen NC et al. (2020): Analysis of SARS-CoV-2-controlled autophagy reveals spermidine, MK-2206, and niclosamide as putative antiviral therapeutics. Biorxiv 2020. [doi: 10.1101/2020.04.15.997254]
- Abdellatif M et al. (2020): Autophagy in cardiovascular health and disease. Prog Mol Biol Transl Sci 2020;172:87-106. [doi: 10.1016/bs.pmbts.2020.04.022] [PubMed: 32620252]
- Gosh I et al. (2020): Spermidine, an autophagy inducer, as a therapeutic strategy in neurological disorders. Neuropeptides 2020;83:102083. [doi: 10.1016/j.npep.2020.102083] [PubMed: 32873420]
- Gupta VK et al. (2013): Restoring polyamines protects from age-induced memory impairment in an autophagy-dependent manner. Nat Neurosci 2013;16(10):1453-1460. [doi: 10.1038/nn.3512] [PubMed: 23995066]
- Huang J et al. (2020): Spermidine Exhibits Protective Effects Against Traumatic Brain Injury. Cell Mol Neurobiol 2020;40(6):927-937. [doi: 10.1007/s10571-019-00783-4] [PubMed: 31916070]
- Ilgarashi K, Kashiwagi K (2010): Modulation of cellular function by polyamines. Int J Biochem Cell Biol 2010;42(1):39-51. [doi: 10.1016/j.biocel.2009.07.009] [PubMed: 19643201]
- Kiechl S et al. (2018): Higher spermidine intake is linked to lower mortality: a prospective population-based study. Am J Clin Nutr 2018;108(2):371-380. [doi: 10.1093/ajcn/nqy102] [PubMed: 29955838]
- Kim J (2017): Spermidine rescues proximal tubular cells from oxidative stress and necrosis after ischemic acute kidney injury. Arch Pharm Res 2017;40(10):1197-1208. [doi: 10.1007/s12272-017-0957-3] [PubMed: 28914418]
- La Rocca TJ et al. (2013): The autophagy enhancer spermidine reverses arterial aging. Mech Ageing Dev 2013;134(7-8):314-320. [doi: 10.1016/j.mad.2013.04.004] [PubMed: 23612189]
- Larque E et al. (2007): Biological significance of dietary polyamines. Nutrition 2007;23(1):87-95. [doi: 10.1016/j.nut.2006.09.006] [PubMed: 17113752]
- Li G et al. (2020): Spermidine Suppresses Inflammatory DC Function by Activating the FOXO3 Pathway and Counteracts Autoimmunity. iScience 2020;23(1):100807. [doi: 10.1016/j.isci.2019.100807] [PubMed: 31962236]
- Liu S et al. (2020): Spermidine Suppresses Development of Experimental Abdominal Aortic Aneurysms. J Am Heart Assoc 2020;9(8):e014757. [doi: 10.1161/jaha.119.014757] [PubMed: 32308093]
- Löser C et al. (1999): Dietary polyamines are essential luminal growth factors for small intestinal and colonic mucosal growth and development. Gut 1999;44:12-16. [doi: 10.1136/gut.44.1.12] [PubMed: 9862820]
- Madeo F et al. (2010): Spermidine: a novel autophagy inducer and longevity elixir. Autophagy 2010;6(1):160-162. [doi: 10.4161/auto.6.1.10600] [PubMed: 20110777]
- ebd., siehe [27].
- Madeo F et al. (2018): Spermidine in health and disease. Science 2018;359(6374):eaan2788. [doi: 10.1126/science.aan2788] [PubMed: 29371440]
- Madeo F et al. (2019): Spermidine: a physiological autophagy inducer acting as an anti-aging vitamin in humans? Autophagy 2019;15(1):165–168. [doi: 10.1080/15548627.2018.1530929] [PubMed: 30306826]
- Madeo F et al. (2020): Nutritional Aspects of Spermidine. Annu Rev Nutr 2020;40:135-159. [doi: 10.1146/annurev-nutr-120419-015419] [PubMed: 32634331]
- Mandal S et al. (2013): Depletion of cellular polyamines, spermidine and spermine, causes a total arrest in translation and growth in mammalian cells. Proc Natl Acad Sci 2013;110(6):2169-2174. [doi: 10.1073/pnas.1219002110] [PubMed: 23345430]
- Matsumoto M et al. (2019): Endothelial Function is improved by Inducing Microbial Polyamine Production in the Gut: A Randomized Placebo-Controlled Trial. Nutrients 2019;11(5):1188. [doi: 10.3390/nu11051188] [PubMed: 31137855]
- Méndez JD (2017): The Other Legacy of Antonie Van Leeuwenhoek: The Polyamines. J Clin Mol Endocrinol 2017;2(1):e107. [doi: 10.21767/2572-5432.100041]
- Michiels CF et al. (2016): Spermidine reduces lipid accumulation and necrotic core formation in atherosclerotic plaques via induction of autophagy. Atherosclerosis 2016;251:319-327. [doi: 10.1016/j.atherosclerosis.2016.07.899] [PubMed: 27450786]
- Miller-Fleming L et al. (2015): Remaining mysteries of molecular biology: the role of polyamines in the cell. J Mol Biol 2015;427(21):3389-3406. [doi: 10.1016/j.jmb.2015.06.020] [PubMed: 26156863]
- Milovic V et al. (2001): Permeability characteristics of polyamines across intestinal epithelium using the Caco-2 monolayer system: comparison between transepithelial flux and mitogen-stimulated uptake into epithelial cells. Nutrition 2001;17(6):462-466. [doi: 10.1016/s0899-9007(01)00514-7] [PubMed: 11399404]
- Minois N (2014): Molecular basis of the anti-aging effect of spermidine and other natural polyamines – a minireview. Gerontology 2014;60(4):319-326. [doi: 10.1159/000356748] [PubMed: 24481223]
- Moinard C et al. (2005): Polyamines: metabolism and implications in human diseases. Clin Nutr 2005;24(2):184-197. [doi: 10.1016/j.clnu.2004.11.001] [PubMed: 15784477]
- Morselli E et al. (2011): Spermidine and resveratrol induce autophagy by distinct pathways converging on the acetylproteome. J Cell Biol 2011;192(4):615-629. [doi: 10.1083/jcb.201008167] [PubMed: 21339330]
- Munoz-Esparza NC et al. (2019): Polyamines in Food. Front Nutr 2019;6:108. [doi: 10.3389/fnut.2019.00108] [PubMed: 31355206]
- Nilsson BO, Persson L (2019): Beneficial effects of spermidine on cardiovascular health and longevity suggest a cell type-specific import of polyamines by cardiomyocytes. Biochem Soc Trans 2019;47(1):265-272. [doi: 10.1042/bst20180622] [PubMed: 30578348]
- Noack J et al. (1998): Dietary guar gum and pectin stimulate intestinal microbial polyamine synthesis in rats. J Nutr 1998;128:1385–1391. [doi: 10.1093/jn/128.8.1385] [PubMed: 9687560]
- Noack J et al. (2000): The Human Gut Bacteria Bacteroides thetaiotaomicron and Fusobacterium varium Produce Putrescine and Spermidine in Cecum of Pectin-Fed Gnotobiotic Rats. J Nutr 2000;130(5):1225-1231. [doi: 10.1093/jn/130.5.1225] [PubMed: 10801923]
- ebd., siehe [27].
- Nishimura K et al. (2006): Decrease in polyamines with aging and their ingestion from food and drink. J Biochem 2006;139(1):81–90. [doi: 10.1093/jb/mvj003] [PubMed: 16428322]
- Oryza Oil & Fat Chemocial Co. Ltd., Japan: Brochure on Polyamines, rev. 2, 2011-12-26.
- Pegg AE (2016): Functions of Polyamines in Mammals. J Biol Chem 2016;291(29):14904-14912. [doi: 10.1074/jbc.r116.731661] [PubMed: 27268251]
- Pegg AE (2014): The function of spermine. IUBMB Life 2014;66(1):8-18. [doi: 10.1002/iub.1237] [PubMed: 24395705]
- Pekar T et al. (2020): Spermidine in dementia: Relation to age and memory performance. Wien Klin Wochenschr 2020;132(1-2):42-46. [doi: 10.1007/s00508-019-01588-7] [PubMed: 31832773]
- Pietrocola F et al. (2019): Spermidine reduces cancer-related mortality in humans. Autophagy 2019;15(2):362-365. [doi: 10.1080/15548627.2018.1539592] [PubMed: 30354939]
- Pucciarelli S et al. (2012): Spermidine and spermine are enriched in whole blood of nona/centenarians. Rejuvenation Res 2012;15(6):590-595. [doi: 10.1089/rej.2012.1349] [PubMed: 22950434]
- Rémésy C et al. (1993): Cecal fermentations in rats fed oligosaccharides (inulin) are modulated by dietary calcium level. Am J Physiol 1993;264(5 Pt 1):G855-62. [doi: 10.1152/ajpgi.1993.264.5.g855] [PubMed: 8388642]
- Rocha RO, Wilson RA (2019): Essential, deadly, enigmatic: Polyamine metabolism and roles in fungal cells. Fungal Biology Reviews 2019;33(1):47-57. [doi: 10.1016/j.fbr.2018.07.003]
- Schwarz C et al. (2018): Safety and tolerability of spermidine supplementation in mice and older adults with subjective cognitive decline. Aging (Albany NY) 2018;10(1):19-33. [doi: 10.18632/aging.101354] [PubMed: 29315079]
- Schwarz C et al. (2020): Spermidine intake is associated with cortical thickness and hippocampal volume in older adults. Neuroimage 2020;221:117132. [doi: 10.1016/j.neuroimage.2020.117132] [PubMed: 32629145]
- Soda K et al. (2012): Food polyamine and cardiovascular disease – an epidemiological study. Glob J Health Sci 2012;4(6):170–178. [doi: 10.5539/gjhs.v4n6p170] [PubMed: 23121753]
- Soda K (2020): Spermine and gene methylation: a mechanism of lifespan extension induced by polyamine-rich diet. Amino Acids 2020;52(2):213-224. [doi: 10.1007/s00726-019-02733-2] [PubMed: 31004229]
- Tofalo R et al. (2019): Polyamines and Gut Microbiota. Front Nutr 2019;6:16. [doi: 10.3389/fnut.2019.00016] [PubMed: 30859104]
- Tong D et al. (2017): Spermidine promotes cardioprotective autophagy. Circ Res 2017;120(8):1229-1231. [doi: 10.1161/circresaha.117.310603] [PubMed: 28408448]
- Vargas AJ et al. (2015): Dietary polyamine intake and colorectal cancer risk in postmenopausal women. Am J Clin Nutr 2015;102(2):411-419. [doi: 10.3945/ajcn.114.103895] [PubMed: 26135350]
- Wang J et al. (2020): Spermidine alleviates cardiac aging by improving mitochondrial biogenesis and function. Aging (Albany NY) 2020;12(1):650-671. [doi: 10.18632/aging.102647] [PubMed: 31907336]
- Wirth M et al. (2018): The effect of spermidine on memory performance in older adults at risk for dementia: A randomized controlled trial. Cortex 2018;109:181-188. [doi: 10.1016/j.cortex.2018.09.014] [PubMed: 30388439]
- Xu TT et al. (2020): Spermidine and spermine delay brain aging by inducing autophagy in SAMP8 mice. Aging (Albany NY) 2020;12(7):6401–6414. [doi: 10.18632/aging.103035] [PubMed: 32268299]
- Yan J et al. (2019): Spermidine-enhanced autophagic flux improves cardiac dysfunction following myocardial infarction by targeting the AMPK/mTOR signalling pathway. Br J Pharmacol 2019;176(17):3126-3142. [doi: 10.1111/bph.14706] [PubMed: 31077347]
- Yue F et al. (2017): Spermidine Prolongs Lifespan and Prevents Liver Fibrosis and Hepatocellular Carcinoma by Activating MAP1S-Mediated Autophagy. Cancer Res 2017;77(11):2938-2951. [doi: 10.1158/0008-5472.can-16-3462] [PubMed: 28386016]
- Wikipedia-Eintrag zu Spermidin (deutsche Fassung), siehe https://de.wikipedia.org/wiki/Spermidin
- Wikipedia-Eintrag zu Spermidin (englische Fassung), siehe https://en.wikipedia.org/wiki/Spermidine
- Abdellatif M et al. (2020): Autophagy in cardiovascular health and disease. Prog Mol Biol Transl Sci 2020;172:87-106. [doi: 10.1016/bs.pmbts.2020.04.022] [PubMed: 32620252]
- Pradeep K et al. (2018): Spermidine restores dysregulated autophagy and polyamine synthesis in aged and osteoarthritic chondrocytes via EP300. Exp Mol Med 2018;50(9):1-10. [doi: 10.1038/s12276-018-0149-3] [PubMed: 30232322]
- Levesque S et al. (2019): A synergistic triad of chemotherapy, immune checkpoint inhibitors, and caloric restriction mimetics eradicates tumors in mice. Oncoimmunology 2019;8(11):e1657375. [doi: 10.1080/2162402x.2019.1657375] [PubMed: 31646107]
- Nowotarski SL et al. (2013): Polyamines and cancer: implications for chemotherapy and chemoprevention. Expert Rev Mol Med 2013;15:e3. [doi: 10.1017/erm.2013.3] [PubMed: 23432971]
- Vargas AJ et al. (2012): Dietary polyamine intake and risk of colorectal adenomatous polyps. Am J Clin Nutr 2012;96(1):133-141. [doi: 10.3945/ajcn.111.030353] [PubMed: 22648715]
- Xu L et al. (2020): Polyamine synthesis enzyme AMD1 is closely associated with tumorigenesis and prognosis of human gastric cancers. Carcinogenesis 2020;41(2):214-222. [doi: 10.1093/carcin/bgz098] [PubMed: 31140554]
- Sierra JC et al. (2020): Spermine oxidase mediates Helicobacter pylori-induced gastric inflammation, DNA damage, and carcinogenic signaling. Oncogene 2020;39(22):4465-4474. [doi: 10.1038/s41388-020-1304-6] [PubMed: 32350444]
- Casero RA et al. (2018): Polyamine metabolism and cancer: treatments, challenges and opportunities. Nat Rev Cancer 2018;18(11):681-695. [doi: 10.1038/s41568-018-0050-3] [PubMed: 30181570]
- Soda K (2011): The mechanisms by which polyamines accelerate tumor spread. J Exp Clin Cancer Res 2011;30(1):95. [doi: 10.1186/1756-9966-30-95] [PubMed: 21988863]
- Linsalata M et al. (2014): Pharmacological and dietary agents for colorectal cancer chemoprevention: effects on polyamine metabolism (review). Int J Oncol 2014;45(5):1802-1812. [doi: 10.3892/ijo.2014.2597] [PubMed: 25119812]
- Murray-Stewart TR et al. (2016): Targeting polyamine metabolism for cancer therapy and prevention. Biochem J 2016;473(19):2937-2953. [doi: 10.1042/bcj20160383] [PubMed: 27679855]
- Diener HC (2017): Gehirngesunde Ernährung: wie Essen vor Demenz schützen kann. Informationsdienst Wissenschaft (IWD), Pressemitteilung der Deutschen Gesellschaft für Neurologie vom 20.09.2017, online veröffentlicht auf idw-online.de/de/news681430
- Wirth M et al. (2019): Effects of spermidine supplementation on cognition and biomarkers in older adults with subjective cognitive decline. (SmartAge)—study protocol for a randomized controlled trial. Alzheimers Res Ther 2019;11(1):36. [doi: 10.1186/s13195-019-0484-1] [PubMed: 31039826]
A.2) Quellen zum Thema Weizenkeime
- Ataollahi M et al. (__YEAR__): The effect of wheat germ extract on premenstrual syndrome symptoms. Iran J Pharm Res 2015;14(1):159-66. [PubMed: 25561922]
- Bálint G et al. (2006): Effect of Avemar – a fermented wheat germ extract – on rheumatoid arthritis. Preliminary data. Clin Exp Rheumatol 2006;24(3):325-28. [PubMed: 16870104]
- Boros LG et al. (2005): Fermented wheat germ extract (Avemar) in the treatment of cancer and autoimmune diseases. Ann N Y Acad Sci 2005;1051:529-42. [doi: 10.1196/annals.1361.097] [PubMed: 16126993]
- Brandolini A, Hidalgo A (2012): Wheat germ: not only a by-product. Int J Food Sci Nutr 2012;63(Suppl 1):71-4. [doi: 10.3109/09637486.2011.633898] [PubMed: 22077851]
- Comin-Anduix B et al. (2002): Fermented wheat-germ extract inhibits glycolysis/pentose cycle enzymes and induces apoptosis through poly(ADP-ribose) polymerase activation in Jurkat T-cell leukemia tumor cells. J Biol Chem 2002;277(48):46408-14. [doi: 10.1074/jbc.m206150200] [PubMed: 12351627]
- Demidov LV et al. (2008): Adjuvant fermented wheat germ extract (Avemar) nutraceutical improves survival of high-risk skin melanoma patients: a randomized, pilot, phase II clinical study with a 7-year follow-up. Cancer Biother Radiopharm 2008;23(4):477-82. [doi: 10.1089/cbr.2008.0486] [PubMed: 18771352]
- Farkas E (2005): Fermented wheat germ extract in the supportive therapy of colorectal cancer. Orv Hetil 2005;146(37):1925-31. [PubMed: 16255377]
- Garami M et al. (2004): Fermented wheat germ extract reduces chemotherapy-induced febrile neutropenia in pediatric cancer patients. J Pediatr Hematol Oncol 2004;26(10):631-5. [PubMed: 15454833]
- Koh EM et al. (2018): Anticancer activity and mechanism of action of fermented wheat germ extract against ovarian cancer. J Food Biochemistry 2018;42(6) [doi: 10.1111/jfbc.12688]
- Mahmoud AA et al. (2015): Wheat Germ: An Overview on Nutritional Value, Antioxidant Potential and Antibacterial Characteristics. Food and Nutrition Sciences 2015;6(2):265-77. [doi: 10.4236/fns.2015.62027]
- Marcsek Z et al. (2004): The efficacy of tamoxifen in estrogen receptor-positive breast cancer cells is enhanced by a medical nutriment. Cancer Biother Radiopharm 2004;19(6):746-53. [doi: 10.1089/cbr.2004.19.746] [PubMed: 15665622]
- Mohammadi H et al. (2020): The effects of wheat germ supplementation on metabolic profile in patients with type 2 diabetes mellitus: A randomized, double-blind, placebo-controlled trial. Phytother Res 2020;34(4):879-85. [doi: 10.1002/ptr.6570] [PubMed: 31828863]
- Moreira-Rosario A et al. (2020): Daily intake of wheat germ-enriched bread may promote a healthy gut bacterial microbiota: a randomised controlled trial. Eur J Nutr 2020;59(5):1951-61. [doi: 10.1007/s00394-019-02045-x] [PubMed: 31325040]
- Mueller T, Voigt W (2011): Fermented wheat germ extract – nutritional supplement or anticancer drug? Nutr J 2011;10:89. [doi: 10.1186/1475-2891-10-89] [PubMed: 21892933]
- Ojo BA et al. (2019): Wheat Germ Supplementation Increases Lactobacillaceae and Promotes an Antiinflammatory Gut Milieu in C57BL/6 Mice Fed a High-Fat, High-Sucrose Diet. J Nutr 2019;149(7):1107-15. [doi: 10.1093/jn/nxz061] [PubMed: 31162575]
- Ojo BA et al. (2017): Wheat germ supplementation alleviates insulin resistance and cardiac mitochondrial dysfunction in an animal model of diet-induced obesity. Br J Nutr 2017;118(4):241-49. [doi: 10.1017/s0007114517002082] [PubMed: 28875871]
- Ostlund R et al. (2003): Inhabitation of cholesterol absorption by phytosterol replete wheat germ. Am J Clin Nutr 2003;77(6):1385-9. [doi: 10.1093/ajcn/77.6.1385] [PubMed: 12791614]
- Telekes A et al. (2009): Avemar (wheat germ extract) in cancer prevention and treatment. Nutr Cancer 2009;61(6):891-9. [doi: 10.1080/01635580903285114] [PubMed: 20155632]
- Zhao FL et al. (2014): Analysis of nutritional components of wheat germ from different producing areas. Modern Food Science and Technology 2014;30(3):182-8. [ResearchGate: 286522210]

Spermidin und Weizenkeime: Ein beeindruckendes Duo mit zahlreichen Funktionen
1. Auflage 2021
(auch als professionell gedrucktes Heft im DIN A5 Format erhältlich. — Sprechen Sie uns einfach im Rahmen Ihrer nächsten Bestellung über unsere üblichen Kontaktwege an.)

