Dieser Artikel aus der Reihe „Neue Wege zur Gesundheit” fasst das aktuelle Wissen zu Probiotika zusammen, erörtert die besonderen Eigenschaften verschiedenster probiotischer Bakterienstämme, und beantwortet häufige Fragen zur Wirkungsweise und zur Anwendung von Probiotika.
— ein Gastbeitrag von S. Olmstead (MD), D. Wolfson (ND), D. Meiss (PhD) und J. Ralston (BS) —
Einleitung
Wussten Sie schon, dass der menschliche Darm unter normalen Umständen ungefähr 100 Billionen (100.000.000.000.000) Mikroorganismen entlang der rund 7 Meter langen „Verdauungsstrecke” von Dünn- und Dickdarm „beherbergt” — während der gesamte menschliche Körper aus „nur” 30-50 Billionen Zellen zusammengesetzt ist?
Zu dieser enormen Biomasse gehören geschätzte 1.800 Gattungen und 15.000 bis 36.000 verschiedene Bakterienarten, die eine starke Stoffwechselaktivität entfalten und für die menschliche Gesundheit von wesentlicher Bedeutung sind. Neben der Förderung normaler Magen-Darm-Funktionen und dem Schutz gegenüber Infektionen hat die Darmmikroflora auch wichtige Wirkungen auf den systemischen Stoffwechsel und die Immunfunktion. Zwar ist die genaue Rolle für viele dieser Organismen noch nicht bekannt, aber sowohl die wissenschaftliche Grundlagenforschung als auch die klinische Forschung haben erste Erkenntnisse zu den vielfältigen Funktionen gesunder intestinaler Mikrobiota erbracht. Probiotika sind entweder Arten, die zu den essenziellen Darmmikrobiota gehören, oder es sind transiente Arten, die bei ihrer Passage des Magen-Darm-Trakts einen Nutzen entfalten.
Probiotika: Definitionen und Arten
In den ersten Jahren des 20. Jahrhunderts berichtete der Nobelpreisträger Ilja Iljitsch Metschnikow über die gesundheitsfördernde und lebensverlängernde Wirkung des Verzehrs fermentierter Milchprodukte. Er postulierte, dass die Aufnahme lebender Milchsäurebakterien das Gleichgewicht der gastrointestinalen Mikrobiota verbessert.
1965 führten dann Lilly und Stillwell die Bezeichnung „Probiotika“ für die von Mikroorganismen produzierten wachstumsfördernden Faktoren ein.
Fuller machte das Wort „Probiotika“ 1989 größeren Kreisen bekannt und beschrieb Probiotika als lebende mikrobielle Futtermittelergänzungen, die durch Verbesserung des mikrobiellen Gleichgewichts im Darm einen Nutzen für den Wirt haben.
Ein Konsens-Dokument des International Life Sciences Institute Europe schlug 2001 eine einfache und inzwischen weitverbreitete Definition von Probiotika vor: „lebensfähige mikrobielle Nahrungsergänzungsmittel, die einen günstigen Einfluss auf die menschliche Gesundheit haben“.
- Milchsäure produzierende Bakterien
- andere Bakterienstämme, die keine Milchsäure produzieren
- sowie nicht-pathogene Hefen.
In den vergangenen Jahren wurden diverse Techniken zur molekularen Typisierung entwickelt oder verfeinert, die eine korrekte Identifizierung verschiedenster Mikroorganismen, die sich im Innern unseres Verdauungstrakts tummeln, bis auf Stammebene erlauben. Die leistungsstärksten dieser Methoden können selbst winzige Abweichungen der DNA- und RNA-Muster erkennen und so einen „gentechnischen Fingerabdruck“ sämtlicher Mikroorganismen erstellen, die unseren Darm besiedeln.
Das darauf basierende Instrumentarium zur Identifizierung einzelner Bakterienstämme und anderer Mikroorganismen wird immer häufiger eingesetzt, um das Vorliegen, den Verbleib und die Auswirkungen verschiedenster Probiotika im Magen-Darm-Trakt zu analysieren.
Milchsäure produzierende Bakterien
Bakterien aus der Gattung „Lactobacillus”
Bakterien aus der Gattung lactobacillus stellen nur einen kleinen aber dennoch enorm wichtigen Anteil der menschlichen Mikrobiota des Darms dar. Diese sind in der Regel zahlreicher im Dünndarm vertreten als im Dickdarm, da die Gesamtheit aller „weiter oben“ bzw. „weiter unten“ angesiedelten Lactobacillus-Arten in „fakultativ anaerober“ Weise zusammen arbeitet (wobei manche Arten wie L. plantarum auch Sauerstoff veratmen und in Wasserstoffperoxid umwandeln können).
- L. acidophilus
- L. fermentum
- L. paracasei
- L. brevis
- L. gasseri
- L. plantarum
- L. bulgaricus
- L. helveticus
- L. reuteri
- L. casei
- L. jensenii
- L. rhamnosus
- L. crispatus
- L. johnsonii
- L. salivarius
Bakterien aus der Gattung „Bifidobacterium”
Eine weitere gut erforschte Gruppe von Milchsäure produzierenden Bakterien umfasst diverse Stämme aus der Gattung bifidobacterium. Bifidobakterien sind streng anaerob und daher normalerweise v.a. im Dickdarm zahlreich vertreten.
- B. adolescentis
- B. breve
- B. longum
- B. animalis
- B. infantis
- B. thermophilum
- B. bifidum
- B. lactis
Bakterien aus der Gattung „Pediococcus”
Pediococcus ist eine phylogenetisch mit Lactobacillus verwandte Gattung Milchsäure produzierender Bakterien. Pediokokken werden häufig in der Fermentierung von Nahrungsmitteln verwendet, weil sie geschmacksverleihende Eigenschaften haben und antimikrobielle Bakteriozine (oder Pediozine) freisetzen. Solche Bakteriozine-produzierenden Pediokokken sind aus dem menschlichen Darm isoliert worden, und manche Arten wie P. acidilactici weisen besonders nützliche probiotische Eigenschaften auf.
P. acidilactici produziert mehrere Arten von Pediozin und bildet große Mengen antimikrobiellen Wasserstoffperoxids. Der Organismus verträgt Säure und Galle besser als viele häufig verwendete Lactobacillus-Arten und ist gegenüber vielen Antibiotika resistent.
Bei Tieren konnte gezeigt werden, dass P. acidilactici das Wachstum fördert, trophisch auf die Darmschleimhaut wirkt und die Translokation enterotoxischer Escherichia coli aus dem Darmlumen in die Mesenteriallymphknoten signifikant hemmt. Studien deuten darauf hin, dass P. acidilactici durch das Heraufregulieren der Produktion regulatorischer T-Zellen auch an der Unterdrückung autoimmuner Pathologien beteiligt sein kann.
P. acidilactici wurde bisher nur in wenigen Studien mit Menschen untersucht, aber eine dieser Studien ergab, dass eine kurzfristige intravaginale Verabreichung des Organismus zusammen mit mehreren Lactobacillus-Arten die Heilungsraten und klinischen Ergebnisse bei Frauen verbesserten, die aufgrund einer bakteriellen Vaginose oder vulvovaginalen Candidiasis behandelt wurden.
Andere Darm-Bakterien: Welche Arten sind schädlich, und welche sind nützlich?
Bakterien aus der Gattung “Bacillus”
Bacillus-Arten sind ubiquitäre fakultative oder obligat anaerobe sporenbildende Organismen, die im Boden und Wasser zu finden sind. Früher wurden sie zwar als transiente, nicht kolonisierende Mitglieder der Darmmikrobiota angesehen, jedoch deuten neuere Forschungsarbeiten darauf hin, dass sich manche Bacillus-Arten wie B. subtilis an das Leben im menschlichen Magen-Darm-Trakt angepasst haben, häufig daraus isoliert werden und als kommensale Mikroorganismen betrachtet werden sollten.
Die Sporen einer Reihe von Bacillus-Arten werden als Probiotika eingesetzt und oft als bodenbasierte Probiotika bezeichnet. Hierbei haben insbesondere die Bacillus-Arten B. subtilis, B. coagulans, B. licheniformis und B. cereus einen Nutzen gezeigt.
In Tierstudien wurde nachgewiesen, dass Bacillus-Probiotika diverse antimikrobielle Stoffe produzieren, die gegen Pathogene wirken und das Immunsystem in günstiger Weise stimulieren. Allerdings sind auch Toxizitäten für Bacillus-Arten gut belegt, darunter die mögliche Produktion von Enterotoxinen. Bei Probiotikaprodukten mit Bacillus gab es Probleme mit falschen Kennzeichnungen und sie leiden unter der Assoziation mit Gastroenteritis und Diarrhö. Daher ist es wichtig, nur gut beschriebene Bacillus-Probiotika von renommierten Herstellern zu verwenden.
Bakterien aus der Gattung „Streptococcus”
Bakterien aus der Gattung streptococcus werden in der Regel nicht mit einer gesundheitsfördernden Wirkung in Verbindung gebracht. Viele von ihnen sind sogar als hoch pathogen einzustufen.
Es gibt allerdings auch Streptokokken, die sich im Allgemeinen förderlich auf die Darmgesundheit auswirken: Hier ist in erster Linie das fakultativ anaerob arbeitende Bakterium Streptococcus thermophilus zu nennen, das (neben dem Laktobazillus L. bulgaricus) zu den beiden wichtigsten Arten in Joghurtkulturen zählt.
Bakterien aus der Gattung „Enterococcus”
Das in einer Reihe probiotischer Produkte enthaltene fakultativ anaerobe Bakterium Enterococcus faecium verfügt über eine Reihe nützlicher Eigenschaften.
Allerdings hat sich E. faecium von einem relativ nicht pathogenen Begleitbakterium zur dritthäufigsten Ursache nosokomialer Infektionen entwickelt und macht jetzt mehr als 10% der klinischen Isolate von Enterokokken aus. Es hat auch eine ausgedehnte Resistenz gegen Antibiotika entwickelt.
Bakterien aus der Gattung „Propionibacterium”
Propionibacterium-Arten sind grampositive, keine Sporen bildende pleomorphe Stäbchen, die im Jahr 1906 erstmals beschrieben wurden. Sie leben in der Regel anaerob, jedoch vertragen einige Stämme sehr geringe Mengen an Luft (Mikroaerophilie). Hauptprodukte ihrer Gärprozesse sind Propionsäure, Essigsäure und Kohlendioxid. Propionibacterium-Arten sind oft auf der Haut zu finden. Propionibakterien stimulieren das Wachstum von Bifidobakterien, dämmen pathogene Populationen fäkaler Staphylococcus- und Enterobacteriaceae-Arten ein, senken die Konzentration karzinogener Enzyme und modulieren das Immunsystem in günstiger Weise. Ausgewählte Propionibacterium-Arten weisen ein probiotisches Potenzial auf.
Bakterien aus der Gattung „Escherichia”
Escherichia coli Nissle 1917 ist ein nützlicher Escherichia-Stamm, dem die Virulenzfaktoren fehlen, für die andere E.-coli-Serotypen bekannt sind. Es konnte gezeigt werden, dass E. coli Nissle 1917 gegen enteropathogene Mikroorganismen wirkt, entzündungshemmend ist, die zelluläre und humorale Immunreaktion verbessert und die Integrität der Darmbarriere stärkt. Die gezielte Verabreichung / Einnahme dieses Darmbakteriums hat sich bei einer Reihe gastrointestinaler Erkrankungen klinisch bewährt, insbesondere bei unspezifischer Diarrhö (Durchfall) und bei diversen entzündlichen Darmerkrankungen.
Probiotische Hefen
Hefepilze aus der Gattung „Saccharomyces”
Die Hefepilz-Gattung saccharomyces umfasst zahlreiche Arten und Unterarten (oder Stämme), von denen eigentlich nur die Untergattung S. boulardii als Probiotikum verwendet wird.
Dieser von Magensäure und Gallenflüssigkeit unbeeinträchtigte Organismus kann sich entlang des gesamten Magen-Darm-Trakts ansiedeln und vermehren. Er ist sowohl allein als auch in Kombination mit anderen Probiotika eingesetzt worden, um eine Reihe gastrointestinaler Erkrankungen erfolgreich zu behandeln, insbesondere Diarrhö und durch Clostridium difficile hervorgerufene Krankheiten.
Wirkmechanismen und Nutzen der wichtigsten Arten/Untergruppen in probiotischen Lebensmitteln und Nahrungsergänzungen
Probiotische Bakterien-Stämme aus der Gruppe „Lactobacillus”
Bei den oben aufgelisteten Lactobacillus-Arten handelt es sich im Wesentlichen um Gram-positive, keine Sporen bildende Stäbchen- oder Kokko-Bazillen (länglich-oval). Eine weitere Gemeinsamkeit besteht darin, dass alle Laktobakterien — wie der Name schon sagt — im Zuge ihrer Stoffwechsel-Aktivitäten permanent Milchsäure (= „Laktat”) bilden. Dem entsprechend werden Darmbakterien der Gattung lactobacillus entweder als homofermentativ eingestuft (was bedeutet, dass Milchsäure das wichtigste Endprodukt ihrer Gärprozesse ist) oder als heterofermentativ (mit Milchsäure, Kohlendioxid, Ethanol und Essigsäure als wichtigsten Endprodukten der Fermentation).
Der Umstand, dass sich Laktobakterien im Innern des menschlichen Verdauungstrakts bevorzugt entlang des Dünndarms ansiedeln, hat zwei Gründe:
1.) Zum einen sind die o. g. Laktobazillen hinsichtlich ihrer Lebensdauer und Vermehrungsrate auf die permanente Zufuhr von Sauerstoff und anderen Substanzen angewiesen, deren Vorhandensein „nach unten hin, in Richtung Dickdarm” kontinuierlich abnimmt.
2.) Zum anderen können sich Laktobazillen schon allein deshalb, weil sie permanent selber Milchsäure und ggf. auch Essigsäure produzieren (s.o.), in aller Regel viel besser an das überwiegend saure Milieu anpassen, das aufgrund der Magensäure in den oberen Bereichen des Verdauungstrakts vorherrscht, als jene anderen Darmbakterien, die eher das basische Milieu im Bereich des Dickdarms bevorzugen.
Seit der Einführung der genetischen Typisierungs- und Hybridisierungs-Technologien hat sich die Lactobacillus-Klassifizierung rasant entwickelt. Aktuell sind mehr als 100 einzelne Unterarten anerkannt, denen eine wesentliche Rolle im Rahmen der Darmgesundheit und Verdauungstätigkeit zugesprochen wird.
Laktobazillen verfügen über viele wichtige Merkmale, die sie als Probiotika wertvoll machen. Dazu zählen:
- die Produktion von Enzymen, die bestimmte Proteine und Kohlehydrate verdauen und metabolisieren,
- die Synthese von B-Vitaminen und Vitamin K,
- der Abbau von Gallensalzen,
- die Stärkung der angeborenen und der erworbenen Immunität,
- sowie die Hemmung entzündungsfördernder Mediatoren
Desweiteren zeigen bestimmte Lactobacillus-Arten auch antimikrobielle Wirkungen gegen eine Reihe von Pathogenen wie Pseudomonas, E. coli, Staphylococcus aureus, Salmonella, Shigella, Candida und Helicobacter pylori.
Am besten untersucht ist zweifellos der Stamm L. acidophilus. Allerdings wurde über mehrere Jahrzehnte eine Reihe von Laktobazillen fälschlich als L. acidophilus klassifiziert, weil sich erst in jüngster Zeit gezeigt hat, dass es sich dabei um eigene Arten mit unterscheidbaren und einzigartigen möglichen gesundheitsfördernden Eigenschaften handelte. Die damit verbundene Neuklassifizierung hat zu einiger Verwirrung geführt, da viele der gesundheitsfördernden Wirkungen, die ehemals „L. acidophilus“ zugeschrieben wurden, heute anderen Lactobacillus-Arten zugeordnet werden.
Eine dieser Arten, L. rhamnosus, wird derzeit als besonders nützlich erachtet, obwohl dieser Organismus erst 1989 als eigenständige Art erkannt wurde und lange nicht als besonders nützlich galt. Die Fortschritte bei der Neuklassifizierung von ehemals als „L. acidophilus“ eingestuften Arten waren wesentlich verantwortlich für die Ergebnisse der 1990 von Hughes veröffentlichten Studie zu Probiotika: Praktisch keines der untersuchten „L.-acidophilus“-Präparate enthielt tatsächlich L. acidophilus. Als häufigste Art in dieser Studie wurde L. rhamnosus identifiziert.
Somit sind die Stämme von L. rhamnosus wahrscheinlich die am eingehendsten untersuchten Probiotika. Viele Studien haben wiederholt gezeigt, dass L. rhamnosus GG eine rotavirusbedingte Diarrhö behandeln und verhindern kann, eine antibiotikumbedingte Diarrhö vermeiden und durch Clostridium difficile verursachte Diarrhö behandeln kann. L. rhamnosus verfügt über wesentliche immunmodulatorische Eigenschaften. Die Wirkung von L. rhamnosus GG wurde bei Säuglingen und Kleinkindern mit Kuhmilchallergie und Neurodermitis untersucht und war im Vergleich zu einem Placebo mit wesentlichen Verbesserungen verbunden. Das Probiotikum senkte mehrere intestinale Entzündungsmarker bei den Kindern, was möglicherweise auf eine verbesserte Darmbarrierefunktion und so auf eine reduzierte Antigen-Translokation zurückzuführen ist. Zwei jüngere Studien haben darüber hinaus den Nutzen von L. rhamnosus GG bei der Vorbeugung und Behandlung von Neurodermitis und Ekzemen bei Säuglingen und Kleinkindern nachgewiesen.
Früher ging man davon aus, dass L. acidophilus im menschlichen Magen-Darm-Trakt heimisch ist und dass der Verzehr von L. acidophilus die normale Mikrobiota wieder aufbaut. Heute weiß man jedoch, dass nicht L. acidophilus im Darm beheimatet ist, sondern andere Arten, die früher fälschlich unter dieser Bezeichnung geführt wurden und heute beispielsweise als L. gasseri, E. crispatus und L. johnsonii bekannt sind.
Die meisten Lactobacillus-Stämme kommen nicht ursprünglich im menschlichen Magen-Darm-Trakt vor, besiedeln den Darm jedoch, wenn sie regelmäßig verzehrt werden. Vegetarisch lebende Menschen und Menschen mit einer traditionellen pflanzlichen Ernährungsweise zeigen hohe Besiedlungsraten bestimmter Laktobazillen wie L. plantarum, L. rhamnosus und L. acidophilus. Menschen, die sich mit den stark verarbeiteten Lebensmitteln der Industrieländer ernähren, zeigen dagegen nur geringe Besiedlungsraten mit diesen wichtigen Mikroorganismen.
Probiotische Bakterien-Stämme aus der Gruppe „Bifidobacterium”
Am Ende des 19. Jahrhunderts wurden Bifidobakterien als unregelmäßige Y-förmige Bakterien beschrieben und als Bacillus bifidus bezeichnet. Im 20. Jahrhundert wurden sie lange als zur Gattung Lactobacillus gehörig klassifiziert, weil sie Milchsäure produzieren. Zahlreiche Studien, aus denen sich eine einzigartige Physiologie und spezifische Nährstoffansprüche ergaben, führten 1960 dann zur Schaffung der eigenen Gattung Bifidobacterium, die heute mehr als 30 Arten umfasst.
Bifidobakterien sind fast immer streng anaerobe Stäbchen, die keine Sporen bilden. Sie gehören zu den häufigeren Milchsäure produzierenden Bakterien im menschlichen Darm und konkurrieren im Dickdarm mit Bacteroides-Arten um die Vorherrschaft. Bei gesunden, gestillten Säuglingen machen sie 95% der Bakterienpopulation im Darm aus. Im Darm von Erwachsenen bleiben Bifidobacterium-Populationen in der Regel stabil, können jedoch mit zunehmendem Alter abnehmen, was möglicherweise sogar zur Alterung beiträgt. Durch Antibiotika und andere Umweltgifte können sie zahlenmäßig stark reduziert werden.
Das Vorhandensein von Bifidobakterien im Darm ist mit zahlreichen gesundheitsförderlichen Faktoren verbunden. Aus ernährungstechnischer Sicht ist es günstig, dass sie u.a. …
- Laktose (Milchzucker) verstoffwechseln — d. h. Bifidobakterien sind insbesondere für Personen mit Laktose-Intoleranz wichtig;
- die L(+)-Form der Milchsäure erzeugen (also L-Laktat statt D-Laktat bilden);
- bestimmte Vitamine synthetisieren;
- unverdauliche Kohlehydrate fermentieren und dabei nützliche kurzkettige Fettsäuren produzieren.
Darüber hinaus zeigten Bifidobakterien im Rahmen diverser Studien auch viele weitere nützliche Eigenschaften:
- Die Bifidobakterien B. bifidum als auch B. breve und B. lactis verfügen über Eigenschaften, die schützende / lindernde Effekte gegen akute Diarrhö (Durchfall) entfalten.
- Für B. longum und B. bifidum konnte nachgewiesen werden, dass sie Häufigkeit und Dauer von Antibiotika-bedingter Diarrhö und von Reisedurchfällen verringern. Dies wird in erster Linie darauf zurück geführt, dass beide Stämme die dafür verantwortlichen Pathogene durch die Produktion von organischen Säuren und Wasserstoffperoxid hemmen, während sie gleichzeitig einen allgemein stimulierenden Effekt auf das Immunsystems des Wirts ausüben.
- Für viele Bifidobacterium-Arten wurde gezeigt, dass sie gegen Verstopfung helfen, entzündliche Darmerkrankungen lindern, die Darmpermeabilität reduzieren und den Serum-Cholesterinspiegel senken.
- In Studien am Tiermodell erwiesen sich die Bifidobakterien B. longum und B. breve als „Schutzfaktor” gegenüber bestimmten Schäden an der DNA, was darauf hindeutet, dass bifidogene Probiotika das Auftreten bestimmter Krebsarten verhindern oder verzögern können.
Probiotische Hefen aus der Gruppe „Saccharomyces boulardii”
S. boulardii, früher als „S. cervesiae Variante boulardii Hansen CBS 5926” bezeichnet, ist eine nicht kolonisierende, Milchsäure bildende Hefe, die weltweit als nützliches Probiotikum eingesetzt wird.
Klinische Studien haben gezeigt, dass sich S. boulardii bei der Behandlung vieler Darmerkrankungen als hilfreich erwiesen hat. Hierzu zählen insbesondere die Behandlung bzw. Vermeidung von diversen durch das Clostridium C. difficile bedingten Erkrankungen, ebenso wie die Linderung bzw. die vorbeugende Verhinderung von Verdauungsbeschwerden im Rahmen einer Antibiotika-Therapie oder bei akuter Diarrhö wie z. B. bei „Reisedurchfällen” sowie bei Patienten mit Sondenernährung. Desweiteren wurde S. boulardii schon mehrfach erfolgreich zur Behandlung AIDS-bedingter Diarrhö und zur Vermeidung von Rezidiven von Morbus Crohn und Colitis ulcerosa eingesetzt.
Die günstige Wirkung dieser probiotischen Hefepilz-Gattung auf den Magen-Darm-Trakt ihres Wirts beruht auf verschiedenen Wirkmechanismen: Zum einen entfaltet S. boulardii offenbar eine direkte Schutzwirkung gegen die Darm-Pathogene Vibrio cholerae und E. coli. Mittlerweise konnte auch in vivo nachgewiesen werden, dass S. boulardii Proteasen (= proteinspaltende Enzyme) und andere Substanzen freisetzt, die bakterielle Enterotoxine abbauen und deren Bindung an Rezeptoren im Darm verhindern. Darüber hinaus ist S. boulardii diversen Studien zufolge auch dazu in der Lage, die Immunabwehr im Darm des Wirts zu stimulieren, eine übermäßige Absonderung von Darmsekreten zu verringern, diverse durch Enterotoxine ausgelöste Entzündungsreaktionen zu hemmen, die Permeabilität (= Durchlässigkeit) der Darmschleimhaut für verschiedenste Pathogene zu reduzieren, und auch die Produktion trophischer Faktoren im Darm wie Enzyme der Bürstensaummembran und Nährstoff-Transporter zu fördern.
Probiotische Bakterien-Stämme aus der Gruppe „Streptococcus thermophilus” und „Lactobacillus bulgaricus”
Diese beiden Milchsäure-produzierenden Bakterienstämme S. thermophilus und L. bulgaricus sind die wichtigsten in der Joghurtproduktion eingesetzten Kulturen.
Zwar sind beide Arten „transient” in dem Sinne, dass sie den menschlichen Darmtrakt nicht permanent besiedeln; sie haben aber dennoch einen erheblichen Nutzen für die Darmgesundheit, weil sie Laktose (= Milchzucker) verstoffwechseln und dadurch die Folgeerscheinungen einer individuell mehr oder weniger stark ausgeprägten Laktoseintoleranz reduzieren.
Desweiteren konnte mittlerweile auch im Rahmen diverser in-vitro Studien demonstriert werden, dass beide Bakterien-Stämme eine starke antimikrobielle Wirkung gegen Pseudomonas, E. coli, S. aureus, Salmonella und Shigella haben. In manchen Untersuchungen wurde diese Wirkung mit der von L. acidophilus verglichen und als stärker befunden. Dabei zeigte L. bulgaricus auch Wirkung gegen das Heliobakterium H. pylori.
Abgesehen davon werden beide Bakterienstämme — wie schon oben kurz erwähnt — bereits seit Jahrtausenden als unverzichtbarer Bestandteil von Joghurtkulturen zur Förderung von Gesundheit und langer Lebensdauer eingesetzt, und sie werden zweifellos auch weiterhin eine wichtige Rolle als probiotische Nahrungsergänzungsmittel spielen.
Probiotische Bakterien-Stämme aus der Gruppe „Enterococcus faecium”
Das früher (fälschlich) als Streptococcus faecium bezeichnete Bakterium E. faecium ist ein ubiquitärer (d. h.: allgegenwärtiger) Organismus, der in vielen Nahrungsmitteln, im Boden und in Pflanzen vorkommt. Es besiedelt daher üblicherweise „von Natur aus” nicht nur die Haut sondern auch den Darm- und Uro-Genital-Trakt jedes Menschen.
E. faecium ist äußerst robust und widerstandsfähig. Es kann daher auch höheren Temperaturen und niedrigen pH-Werten (Stichwort: Magensäure) in aller Regel deutlich „erfolgreicher” widerstehen als die allermeisten anderen Probiotika.
Mehrere Studien deuten darauf hin, dass E. faecium einer antibiotikabedingten Diarrhö wirksam vorbeugt und sie bekämpft. Es wurde auch zur Behandlung einer akuten Gastroenteritis eingesetzt. Studien haben sowohl in-vitro als auch in-vivo eine hemmende Wirkung gegenüber mehreren pathogenen Keimen gezeigt, darunter S. aureus, E. coli, Salmonella, Clostridium und Listeria.
Allerdings kann E. faecium nicht als kommensales Probiotikum eingesetzt werden, zumal dieses Bakterium auch schwere, oft lebensbedrohliche Infektionen auslösen kann. Der Erwerb von Antibiotika-Resistenzen durch Enterokokkenarten ist ein wachsendes klinisches Problem. Derzeit ist etwa die Hälfte aller klinischen Isolate von E. faecium resistent gegen das äußerst wichtige Antibiotikum Vancomycin. So überwiegen die Risiken des Gebrauchs von E. faecium als Probiotikum zunehmend dessen möglichen Nutzen.
Spezielle Anwendungsziele beim Einsatz von Probiotika
Für probiotische Organismen ist nachgewiesen, dass sie bei einer Vielzahl gastrointestinaler und extraintestinaler Erkrankungen auf eine Weise wirken, die über die Modulation der Darmmikroflora und den Erhalt eines normalen bakteriellen Gleichgewichts kommensaler Bakterien im Darm hinaus geht.
Diarrhö (Durchfall)
Für vier Formen der Diarrhö ist der Nutzen von Probiotika klar belegt, nämlich für Diarrhö, die durch Antibiotika, C. difficile, Rotaviren oder Infektionen bedingt ist. Für durch Antibiotika und C. difficile bedingte Diarrhö ist diese schützende oder heilende Wirkung am besten belegt.
Eine Metaanalyse von 25 randomisierten, kontrollierten Studien mit insgesamt 2.810 Patienten kam zu dem Schluss, dass Probiotika das relative Risiko einer Antibiotika-bedingten Diarrhö signifikant um 57 % senken. Drei Arten von Probiotika erwiesen sich dabei als am günstigsten: S. boulardii, L. rhamnosus GG sowie Probiotika, die mehrere Arten kombinieren.
Eine weitere Metaanalyse von 23 randomisierten, kontrollierten Studien durch die United Kingdom West Midlands Health Technology Assessment Group ergab, dass Probiotika das relative Risiko einer durch C. difficile bedingten Diarrhö signifikant um 46% senken. Immer wieder zeigte sich, dass S. boulardii das Risiko neuer und rezidivierender Fälle von durch C. difficile bedingter Diarrhö senkt. Besonders hilfreich ist S. boulardii bei Erwachsenen, die mehr als eine Episode dieser Durchfallerkrankung durchgemacht haben.
Der durch Rotaviren bedingten Diarrhö, die ein häufiges Problem bei stationär behandelten Kindern ist, lässt sich nachweislich durch L. rhamnosus, L. casei, S. thermophilus und B. bifidum vorbeugen. L. rhamnosus, L. reuteri, L. casei und S. boulardii haben sich als wirksam entweder zur Prävention oder Behandlung nosokomialer infektiöser Diarrhö bei Säuglingen, Kleinkindern und Kindern erwiesen.
Vaginale Dysbiose
Von einer Dysbiose spricht man, wenn die normalen mikrobiellen Ökosysteme von Körpergeweben so gestört sind, dass es zu klinischen Symptomen und Erkrankungen kommt.
Wie die Mikroflora des Darmtrakts kann auch die gesunde vaginale Mikroflora so gestört werden, dass sich unerwünschte Mikroorganismen vermehren, und zwar insbesondere während und nach einer antibiotischen Behandlung. Da die häufigsten Infektionen des Urogenitaltrakts mit einer gestörten vaginalen Mikroflora einhergehen, ist die Wiederherstellung eines gesunden, resilienten Mikrobioms im Vaginaltrakt ein geeignetes Mittel zur Verringerung des Risikos opportunistischer Infektionen.
Traditionell wurden Präparate mit Milchsäure bildenden Bakterien entweder als in Joghurt getränkte Tampons oder Spülungen oder als eingekapselte probiotische Suppositorien eingesetzt und erwiesen sich als klinisch günstig für die Eindämmung des Pathogenwachstums.
Später wurde offensichtlich, dass auch oral verabreichte probiotische Organismen in der Lage sein sollten, den Vaginaltrakt zu besiedeln und urogenitale Infektionen zu verhindern, da aus dem Darm stammende Pathogene ebenfalls in der Lage sind, den Vulvovaginalbereich zu infizieren. Diese Hypothese konnte in einigen klinischen Studien bestätigt werden.
Es wurde gezeigt, dass die orale Verabreichung von Probiotika wie L. acidophilus, L. fermentum und L. rhamnosus in der Lage sind, eine von Lactobacillus dominierte vaginale Mikroflora wiederherzustellen und die Häufigkeit einer bakteriellen Vaginose und vulvovaginalen Candidiasis zu senken. Probiotika können außerdem die Wirksamkeit konventioneller antimikrobieller Therapien ergänzen. In zwei randomisierten, placebokontrollierten Studien mit Frauen mit diagnostizierter bakterieller Vaginose führte die ergänzende orale Gabe von L. rhamnosus und L. reuteri zusätzlich zu den Antibiotika Metronidazo oder Tinidazol zu einer signifikant höheren Heilungsrate als die Behandlung mit den Antibiotika und einem Placebo.
Wirkung gegen Pathogene
Der Einsatz von Probiotika zur Behandlung intestinaler und vaginaler Erkrankungen stützt sich auf die Fähigkeit bestimmter Stämme, das Wachstum von Krankheitserregern einzudämmen.
Im Darmtrakt muss jederzeit ein empfindliches Gleichgewicht zwischen nützlichen und schädlichen Organismen aufrechterhalten werden und viele Faktoren können dieses Gleichgewicht zugunsten der Pathogene verschieben. Zu diesen Faktoren gehören der Gebrauch von Antibiotika, Stress, Alter, schlechte Ernährung, übermäßiger Alkoholkonsum und die Belastung durch Umweltkontaminanten. Frühgeburten, Kaiserschnittentbindung und Flaschenernährung können bei Säuglingen, Kleinkindern und Kindern ebenfalls die Dysbiose der Darmflora begünstigen.
Viele Studien haben bestätigt, dass Probiotika ein günstigeres Gleichgewicht der Darmmikroflora fördern, indem sie Populationen schädlicher Mikroorganismen reduzieren. Das erreichen sie in erster Linie durch die Produktion von für Pathogene toxische Substanzen wie Milchsäure, Essigsäure, Ameisensäure, Wasserstoffperoxid und Bakteriozinen. Außerdem konkurrieren probiotische Bakterien mit Pathogenen um Nährstoffe und Lebensraum im Darm und stören die Bildung pathogener Biofilme. Die Datenlage spricht dafür, dass Bifidobakterien auch in der Lage sind, überschüssiges Eisen aus dem Darm aufzunehmen und so die Pathogene eines wesentlichen Nährstoffs zu berauben, den diese für Wachstum und Virulenz benötigen.
Für die meisten Probiotika konnte gezeigt werden, dass sie gegen eine Vielzahl von Pathogenen wirksam sind, darunter Bakterien, Viren und Pilze (siehe Tabelle 1). Klinisch kann sich die Wiederherstellung eines günstigen Gleichgewichts der Darmmikroflora kurzfristig als das Abklingen von Diarrhö und anderen Magen-Darm-Beschwerden bemerkbar machen. Langfristig kann ein wiederhergestelltes gesundes Gleichgewicht das Risiko einer Vielzahl chronischer degenerativer oder immunologisch vermittelter Erkrankungen senken.
| Probiotikum | Bekämpfte Pathogene |
|---|---|
| Lactobacillus acidophilus | Bacillus cereus, Campylobacter jejuni, Candida albicans, Candida spp., Clostridium difficile, Enterococcus faecalis, Escherichia coli, Helicobacter pylori, Klebsiella pneumoniae, Listeria innocua, Listeria monocytogenes, Porphyromonas gingivalis, Prevotella intermedia, Pseudomonas aeruginosa, rotavirus, Salmonella enterica, Salmonella typhimurium, Shigella flexneri, Staphylococcus aureus, Vibrio cholerae |
| L. bulgaricus | C. difficile, E. coli, L. monocytogenes, rotavirus, Salmonella enteritidis, S. typhimurium, S. aureus, Streptococcus mutans |
| L. casei | C. albicans, C. difficile, E. faecalis, E. coli, H. pylori, L. innocua, L. monocytogenes, P. aeruginosa, rotavirus, S. typhimurium, S. flexneri, S. aureus, Streptococcus pneumoniae, V. cholerae |
| L. gasseri | C. difficile, Cronobacter sakazakii, E. coli, Gardnerella vaginalis, L. monocytogenes, Neisseria gonorrhoeae, P. gingivalis, Prevotella bivia, P. intermedia, S. typhimurium, S. aureus |
| L. paracasei | Actinomyces viscosus, B. cereus, C. albicans, Candida glabrata, Candida tropicalis, C. difficile, E. faecalis, E. coli, H. pylori, P. gingivalis, P. intermedia, P. aeruginosa, S. enterica, Salmonella spp., S. aureus, S. mutans, S. pneumoniae, Streptococcus salivarius, Streptococcus sanguinis |
| L. plantarum | Aspergillus spp., B. cereus, C. albicans, C. difficile, Clostridium sporogenes, E. faecalis, E. coli, H. pylori, L. innocua, L. monocytogenes, R. gingivalis, P. intermedia, P. aeruginosa, Pseudomonas spp., S. enterica, S. mutans |
| L. rhamnosus | A. viscosus, B. cereus, C. albicans, C. glabrata, C. tropicalis, C. difficile, Clostridium perfringens, Enterobacter cloacae, E. faecalis, E. coli, H. pylori, K. pneumoniae, L. monocytogenes, R. gingivalis, P. intermedia, P. aeruginosa, rotavirus, S. enterica, S. typhimurium, S. flexneri, S. aureus, S. mutans, S. salivarius, S. sanguinis |
| L. salivarius | C. difficile, E. faecalis, Enterococcus faecium, E. coli, H. pylori, L. monocytogenes, N. gonorrhoeae, P. gingivalis, R. intermedia, S. enterica, S. enteritidis, S. aureus, Staphylococcus epidermidis, S. mutans |
| Bifidobacterium bifidum | Bacteroides vulgatus, Campylobacter spp., C. difficile, C. perfringens, E. faecalis, E. coli, G. vaginalis, H. pylori, Klebsiella ozaenae, L. monocytogenes, P. aeruginosa, rotavirus. Salmonella spp., Shigella dysenteriae, Shigella sonnei, S. aureus, V. cholerae |
| B. breve | Bacteroides fragilis, B. vulgatus, C. jejuni, Campylobacter spp., C. perfringens, E. faecalis, E. coli, G. vaginalis, Influenza-Virus, K. ozaenae, L. monocytogenes, R. aeruginosa, rotavirus, Salmonella spp., S. sonnei, S. aureus, V. cholerae |
| B. infantis | B. cereus, B. vulgatus, Campylobacter spp., C. albicans, C. difficile, C. perfringens, E. coli, L. monocytogenes, Proteus vulgaris, rotavirus, Salmonella spp., Salmonella typhi, S. sonnei, S. aureus, V. cholerae, Yersinia enterocolitica |
| B. longum | B. vulgatus, Campylobacter spp., C. albicans. C. difficile, C. perfringens, Enterobacter sakazakii, E. faecalis, E. coli, G. vaginalis, H. pylori, K. ozaenae, L. monocytogenes, P. gingivalis, P. aeruginosa, S. enterica, Salmonella spp., S. sonnei, S. aureus, S. mutans, V. cholerae |
| Pediococcus acidilactici | E. faecalis, E. coli, C. perfringens, L. innocua, L. monocytogenes, S. aureus |
| Streptococcus thermophilus | B. fragilis, C. difficile, C. perfringens, E. coli, H. pylori, L. monocytogenes, Rotavirus, S. enteritidis, S. typhimurium, S. aureus, S. mutans |
| Saccharomyces boulardii | Hämolytische Aeromonas-Arten, Blastocystis hominis, C. albicans, C. difficile, Entamoeba histolytica, E. coli, Giardia lamblia, H. pylori, S. typhimurium, V. cholerae, Y. enterocolitica |
Verbesserung der Immunfunktion
Der Darmtrakt ist das primäre Immunorgan des Körpers. Das mit dem Darm verbundene Immunsystem umfasst die größte Lymphgewebemasse im menschlichen Körper, die einen wesentlichen Teil des Gesamtimmunsystems darstellt. Die Darmschleimhaut und das mit dem Darm eng verbundene lymphatische Gewebe sind immunologisch stark mit der gastrointestinalen Mikroflora verknüpft.
Zahlreiche Daten bringen probiotische Bakterien mit der Modulation der wirtsvermittelten Immunantwort in Verbindung. Für probiotische Bakterien konnte gezeigt werden, dass sie sowohl die angeborene als auch die erworbene Immunreaktion stärken, indem sie die Konzentration der zirkulierenden Lymphozyten erhöhen, die Phagozytose und Aktivität natürlicher Killerzellen steigern, die Freisetzung von Immunglobulin A (IgA) und antigenspezifischen Antikörpern stimulieren sowie die Produktion von Interferon-gamma und anderen Zytokinen erhöhen. In klinischen Studien hat sich gezeigt, dass Probiotika die Impfantwort verstärken und die Häufigkeit von Atemwegs- und anderen Infekten deutlich verringern.
Am besten dokumentiert sind diese immunstärkenden Eigenschaften für L. casei, L. rhamnosus, L. plantarum, L. bulgaricus, L. acidophilus, B. bifidum und B. breve. — Zwar sind diese Arten mit ziemlicher Sicherheit nicht die einzigen Probiotika mit immunmodulierender Wirkung, jedoch sollten sie unbedingt Teil jedes Therapieplans zur Unterstützung des Immunsystems sein!
Aufspaltung von schwer verdaulichen Nahrungsbestandteilen
Die Mikrobiota des Dickdarms baut viele Nahrungsbestandteile ab, die der Verdauung im oberen Darmabschnitt entgehen.
Die meisten probiotischen Bakterien sind in der Lage, vielfältige Kohlehydrate zu metabolisieren, darunter auch Laktose. Der Verstoffwechslung von Laktose durch Milchsäure bildende Bakterien verdanken es viele Laktoseintolerante, dass sie Joghurt problemlos vertragen, jedoch keine anderen Molkereiprodukte. Milchsäure produzierende Bakterien vergären Kohlehydrate zu anderen kurz- und mittelkettigen organischen Fettsäuren sowie zu Milchsäure.
Manche Arten setzen auch proteolytische und lipolytische Enzyme frei, die die Verdauung von Proteinen (Eiweiß-Verbindungen) und Fetten (= Lipiden) erleichtern. Menschen mit zu wenig Magensäure, die das proteolytische Enzym Pepsin nicht aktivieren können, und Personen mit Pankreasinsuffizienz profitieren daher von einer Nahrungsergänzung mit Probiotika.
Von einer verbesserten Proteinverdauung können auch Personen mit Allergien profitieren, da diese die Wahrscheinlichkeit dafür senkt, dass große Proteine die Darmschranke passieren, ins Blut gelangen und dann eine Immunreaktion auslösen. Probiotische Arten wie L. bulgaricus, L. plantarum, L. casei und L. rhamnosus setzen nachweislich Enzyme frei, die Kasein und Gluten (allergene Proteine in Milchprodukten bzw. Weizen) abbauen. Manche Probiotika erzeugen auch Enzyme, die toxische Nahrungsbestandteile wie Oxalsäure abbauen können. Oxalat ist eine organische Säure, die in verschiedenen Nahrungsmitteln enthalten ist und bei übermäßigem Verzehr eine Kalzium-Oxalat-Urolithiasis verschlimmern kann. Unter Laborbedingungen produzieren sowohl Lactobacillus als auch Bifidobacterium die oxalatabbauenden Enzyme Formyl-CoA-Transferase und Oxalyl-CoA-Decarboxylase.
Linderung von Nahrungsmittelallergien
Nahrungsmittelallergien sind häufige Krankheiten, deren Symptome von leichten Magen-Darm-Beschwerden bis zu schwerer Atemnot und Anaphylaxie reichen. Bereits vor mehr als 20 Jahren wurde festgestellt, dass Probiotika die Symptome einer Nahrungsmittelallergie lindern können. Seither haben einige gut aufgebaute Studien darauf hingewiesen, dass eine Nahrungsergänzung mit bestimmten probiotischen Stämmen allergische Reaktionen wirksam abschwächen kann.
Bei Säuglingen und Kleinkindern mit Neurodermitis und Kuhmilchallergie verbesserte eine mit L. rhamnosus GG angereicherte Molkeproteinnahrung signifikant die klinischen Symptome und Marker der Darmentzündung. Bei Kindern mit Neurodermitis erwies sich eine Kombination aus L. rhamnosus und L. reuteri als günstig. Eine langfristige Studie bei Kindern mit allergischem Asthma und/oder Schnupfen verglich die Wirkung nicht fermentierter Milch mit der von fermentierter Milch, die L. bulgaricus, S. thermophilus und L. casei enthielt. Nach einem Jahr traten bei den Kindern, die die probiotisch fermentierte Milch erhalten hatten, signifikant weniger Schnupfenepisoden auf und es war ein Trend hin zu längeren Phasen ohne Asthma und Schnupfen zu beobachten.
Probiotika mildern allergische Symptome, indem sie eine Immuntoleranz induzieren und den Kontakt mit Antigenen verringern. Es konnte gezeigt werden, dass Probiotika ein Gleichgewicht zwischen den Zellantworten der T-Helferzellen vom Typ 1 (Th1) und vom Typ 2 (Th2) herstellen und ein gesundes Verhältnis von T-Helferzellen zu regulatorischen T-Zellen fördern. Wie bereits erwähnt können Probiotika außerdem Allergene in der Nahrung enzymatisch abbauen und die Darmbarrierefunktion verbessern, was die Wahrscheinlichkeit verringert, dass Allergene ins Blut gelangen.
Produktion kurzkettiger Fettsäuren
Probiotika, insbesondere die Bifidobakterien, sind in der Lage, unverdauliche Kohlehydrate wie Ballaststoffe abzubauen und zu metabolisieren. Die wichtigsten Nebenprodukte dieses Stoffwechsels sind kurzkettige Fettsäuren wie Laktat, Acetat, Propionat und Butyrat. Diese kurzkettigen Fettsäuren senken den pH-Wert im Darm und schaffen so ein feindliches Milieu für pathogene Bakterien wie E. coli und Salmonella-Arten. Kurzkettige Fettsäuren ernähren auch die Zellen der Dickdarmschleimhaut und decken 60 bis 70 Prozent des Energiebedarfs der Dickdarmzellen, wobei Butyrat die bevorzugte Energiequelle ist.
Studien mit Tieren und Menschen haben gezeigt, dass kurzkettige Fettsäuren die Kalzium-, Magnesium- und Kalium-Resorption im Dickdarm direkt stimulieren, die Durchblutung des Dickdarms verstärken, die Sauerstoffversorgung des Gewebes erhöhen sowie den Nährstofftransport verbessern und daher von therapeutischem Nutzen bei verschiedenen Darmerkrankungen sein können.
Verbesserung der Bioverfügbarkeit von Mineralien
Die Mineralstoffresorption erfordert ein saures Milieu, insbesondere wenn die Mineralstoffe als anorganische Salze vorliegen. In der Regel ist die Magensäure ausreichend für deren Auflösung; falls es jedoch an Magensäure mangelt, dissoziieren Mineralsalze möglicherweise nicht vollständig. Milchsäure produzierende Bakterien fördern die Mineralstoffresorption über die Schaffung eines sauren Mikromilieus im Bereich der Darmschleimhaut und indem sie kurzkettige Fettsäuren bilden, die die für die Resorption erforderlichen Protonen abgeben. In Tierstudien wurde gezeigt, dass Milchsäure produzierende Bakterien insbesondere in Gegenwart eines probiotischen Wachstumsfaktors wie Inulin die Resorption von Kalzium, Magnesium, Kalium und Zink im Darm steigern.
Produktion von Vitaminen
Milchsäure produzierende Bakterien erzeugen kleine Mengen bestimmter B-Vitamine wie Folat (B9) und Vitamin B12. Bei den meisten Tierarten scheint die mikrobielle Vitamin-K-Synthese im Darm von Bedeutung für die Ernährung zu sein. Bifidobakterien, Streptokokken und Enterokokken produzieren nachweislich Vitamin K.
Senkung des Cholesterinspiegels
Forschungsarbeiten deuten darauf hin, dass manche Probiotika den Cholesterinspiegel im Blut senken können. In Kulturstudien entfernen L. casei und L. acidophilus Cholesterin effektiv aus dem Kulturmedium. In Tiermodellen zeigen L. acidophilus, B. bifidum, B. breve und S. thermophilus cholesterinsenkende Wirkung. Untersuchungen am Menschen zur Wirkung von Probiotika auf den Cholesterinspiegel haben weniger eindeutige Ergebnisse erbracht, was wahrscheinlich auf unerkannte Störvariablen und methodologische Unterschiede zurückzuführen ist. Dennoch haben mehrere klinische Prüfungen gezeigt, dass eine Nahrungsergänzung durch Probiotika zu signifikanten Reduktionen des Gesamtcholesterinspiegels und/oder des LDL-Cholesterinspiegels führt. In der Wissenschaft wird postuliert, dass Probiotika den Serumcholesterinspiegel über verschiedene Wirkmechanismen senken können, darunter die Assimilation des Cholesterins im Darm, eine vermehrte Dekonjugation und fäkale Eliminierung von aus dem Cholesterin abgeleiteten Gallensäuren und die Produktion kurzkettiger Fettsäuren, die die Cholesterinsynthese in der Leber stören.
Management entzündlicher Darmerkrankungen
Als entzündliche Darmerkrankungen gelten v. a. zwei chronische oder rezidivierende Krankheiten unbekannter Ursache: Colitis ulcerosa und Morbus Crohn. Beide weisen viele Gemeinsamkeiten, aber auch wichtige Unterschiede auf.
Colitis ulcerosa ist eine entzündliche Erkrankung des Dickdarms, von der häufig das Rektum am stärksten betroffen ist. Die Dickdarmschleimhaut entzündet sich und bildet Geschwüre. Betroffene haben dann Diarrhö, wobei sich häufig Schleim und Blut im Stuhl finden. Morbus Crohn betrifft meistens den distalen Teil des Dünndarms, das terminale Ileum sowie Teile des Dickdarms, kann aber sämtliche Teile des Verdauungstrakts befallen. Beim Morbus Crohn ist meist die gesamte Darmwand entzündet, bei der Colitis ulcerosa nur die Auskleidung des Darms.
Viele Daten deuten darauf hin, dass entzündliche Darmerkrankungen auf eine anomale Aktivierung des Immunsystems in der Schleimhaut gegenüber der Darmflora zurückzuführen sind, durch die entzündliche Mediatoren freigesetzt werden. Folglich besteht in der Gastroenterologie ein erhebliches Interesse am Einsatz von Probiotika für die Behandlung entzündlicher Darmerkrankungen. Für L. rhamnosus (GG) konnte gezeigt werden, dass der Organismus die Integrität der Darmschleimhaut-Barriere bei Patienten mit entzündlichen Darmerkrankungen verbessert, indem dieses Laktobakterium die IgA-Immunreaktion im Darm verstärkt. Die Gabe von B. longum, Inulin und Oligofruktose verringert entzündliche Zytokine und bremst die Dickdarmentzündung bei Patienten mit Colitis ulcerosa oder Morbus Crohn, und S. boulardii senkt die Rückfallrate bei Patienten mit Morbus Crohn signifikant.
Die Pouchitis ist eine Komplikation der chirurgisch behandelten Colitis ulcerosa, bei der der gesamte Dickdarm entfernt und aus dem Ileum ein Reservoir geformt und mit dem Anus verbunden wird. Entzündet sich dieses Reservoir, spricht man von einer Pouchitis. Eine Kombination aus L. casei, L. plantarum, L. acidophilus, L. bulgaricus, B. longum, B. breve, B. infantis und S. thermophilus hat sich bei der Vermeidung einer Pouchitis als wirksam erwiesen und bewirkte sowohl bei Kindern als auch bei Erwachsenen eine Remission entzündlicher Darmerkrankungen. Auch die Gabe von L. rhamnosus allein kann das Auftreten einer Pouchitis nachweislich verzögern.
Linderung des Reizdarmsyndroms
Das Reizdarmsyndrom ist eine häufige, multifaktorielle Magen-Darm-Erkrankung, die durch Blähungen, Diarrhö, Verstopfung und Bauchschmerzen gekennzeichnet ist. Aufgrund der sehr heterogenen Patientengruppen ist diese Erkrankung nicht leicht zu untersuchen, aber klinische Prüfungen mit den Arten B. infantis und L. plantarum haben gezeigt, dass diese Probiotika Symptome des Reizdarmsyndroms wie Bauchschmerzen, Blähungen und Verdauungsbeschwerden lindern konnten.
In einer kleinen Pilotstudie zum Reizdarmsyndrom führte eine Ausschlussdiät mit anschließender Behandlung durch eine probiotische Mischung, die B. bifidum, B. infantis, L. acidophilus, L. rhamnosus, L. plantarum, L. salivarius, L. bulgaricus, L. casei, L. brevis und S. thermophilus enthielt, zu Verbesserung bei Schmerzen, Stuhlhäufigkeit und Bewertung der Lebensqualität. Die Wirksamkeit mehrere Arten enthaltender Präparate bei der Behandlung des Reizdarmsyndroms wurde durch die Ergebnisse einer doppelblinden, placebokontrollierten Prüfung bestätigt, bei der eine Kombination aus zwei Stämmen von L. rhamnosus, B. breve und Propionibacterium freudenreichii spp. shermanii die Symptome Schmerzen, Blähungen und Borborygmus um mehr als 40% minderte.
Antikarzinogene Wirkung
Es mehren sich die Belege dafür, dass Probiotika im Dickdarm antimutagen und antikarzinogen wirken können. In Tiermodellen konnte gezeigt werden, dass Probiotika die Bildung von aberranten Krypten (Präkanzerosen) und Tumoren hemmen.
Antikarzinogene Wirkungen können probiotische Bakterien über eine Vielzahl von Mechanismen entfalten: Milchsäure produzierende Bakterien erzeugen organische Säuren und senken so den pH-Wert im Darm, was stark mit einer geringeren Inzidenz von Dickdarmkrebs assoziiert ist. Milchsäure produzierende Bakterien können an mutagene Substanzen aus der Nahrung binden und diese abbauen, sodass sich die Belastung des Wirts verringert. Durch die Stimulation der Immunabwehrmechanismen des Wirts können Probiotika eine Tumorsuppression vermitteln. Probiotische Bakterien verbessern die Zytokinproduktion, die T- und B-Zellproliferation, die Antikörperantworten und die Aktivierung von Makrophagen und Lymphozyten.
In Tiermodellen mit zuvor implantierten Tumorzellen wurden Belege für die gegen Tumoren gerichtete Wirkung von Milchsäure produzierenden Bakterien gefunden. Auch für die Verfütterung von Kulturen Milchsäure produzierender Bakterien an Mäuse konnte gezeigt werden, dass sie das Wachstum injizierter Tumorzellen hemmen.
Unabhängig von den o. g. antikarzinogenen Effekten haben sich Probiotika auch dabei als hilfreich erwiesen, verschiedenste Arten von Verdauungsbeschwerden zu lindern, die üblicherweise als „Nebenwirkung” im Rahmen einer Chemotherapie auftreten können.
Entgiftung
Probiotika spielen eine wesentliche Rolle bei den körpereigenen Entgiftungsprozessen. Sie begrenzen den systemischen und intestinalen Kontakt mit aufgenommenen Toxinen, indem sie die Darmbarrierefunktion verbessern, Toxine im Darm binden und einschließen und die Toxinproduktion pathogener Arten verringern.
Studien zeigen immer wieder, dass Probiotika die Durchlässigkeit des Darms, insbesondere bei Personen mit beeinträchtigter Magen-Darm-Funktion, verringern und es der Auskleidung des Darms so ermöglichen, den Übertritt schädlicher Substanzen ins Blut zu verhindern. Probiotika binden auch Toxine im Darmlumen, was deren Resorption weiter einschränkt. In-vitro-Studien zeigen, dass Milchsäure produzierende Bakterien direkt an eine Gruppe von Toxinen binden, die als heterozyklische Amine bezeichnet werden und in gegartem Fleisch, Geflügel und Fisch vorkommen. Durch die Bindung wird die Mutagenität dieser Substanzen eingeschränkt und sie werden vermehrt mit dem Stuhl ausgeschieden. Darüber hinaus binden Probiotika schädliche Nahrungsbestandteile wie Schwermetalle und Aflatoxine.
Schwermetalle sind eine bedeutende Klasse von Umweltschadstoffen, die zahlreiche Gesundheitsprobleme verursachen. Das Probiotikum L. rhamnosus bindet unter physiologisch relevanten Bedingungen nachweislich effizient Kadmium und Blei. Beide Schwermetalle sind in der Umwelt weit verbreitet und tragen zu einer Reihe von pathologischen Zuständen bei, wie Knochen- und Nierentoxizität, kognitive Defizite und Neuroverhaltensstörungen. Daten deuten auch darauf hin, dass eine von Probiotika dominierte Mikrobiota die Produktion des toxischen Methylquecksilbers durch Darmpathogene reduzieren kann.
Aflatoxine sind giftige Stoffwechselprodukte von Pilzen, die natürlicherweise in Lebensmitteln wie Zerealien, Nüssen und Samen vorkommen. Sie sind ein bekannter Risikofaktor für das Auftreten des Leberzellkarzinoms. In Tiermodellen konnte gezeigt werden, dass in eine Zwölffingerdarmschlaufe injizierte Stämme von L. rhamnosus in der Lage waren, bis zu 54% einer injizierten Dosis Aflatoxin B1 nach nur einer Minute zu beseitigen. Nach 60-minütiger Inkubation war die Aflatoxin-B1-Menge um mehr als 90% reduziert.
Ebenfalls besonders hilfreich beim Umgang mit von Darmpathogenen produzierten Toxinen ist die probiotische Art S. boulardii. Diese probiotische Hefe produziert ein proteolytisches Enzym, das durch Lyse der A- und B-Toxine von C. difficile dessen enterotoxische und zytotoxische Wirkung mindert. Außerdem hemmt S. boulardii signifikant die Fähigkeit dieser Toxine, an das Darmepithel zu binden. In einer Studie, in der mit C. difficile infizierte Mäuse untersucht wurden, führte eine Vorbehandlung mit S. boulardii zu einer 1000-fachen Reduktion des Toxins im Stuhl. Es konnte auch gezeigt werden, dass S. boulardii die Enterotoxizität der Toxine von E. coli und V. cholerae neutralisiert. Diese Wirkungen sind wahrscheinlich wesentlich dafür verantwortlich, dass S. boulardii die Antibiotika-bedingte und C.-difficile-bedingte Diarrhö lindern kann.
Nutzen bei Autismus-Spektrum-Störungen
Autismus-Spektrum-Störungen sind neurologische Entwicklungsstörungen, die durch soziale Zurückgezogenheit, wiederholte oder eingeschränkte Verhaltensmuster und Kommunikationsstörungen gekennzeichnet sind. Personen im Autismus-Spektrum weisen häufig eine ganze Palette gastrointestinaler Anomalitäten wie eine dysbiotische Mikrobiota, gastrointestinale Entzündung, anomale Dickdarmmotilität, mangelhafte Enzymproduktion und erhöhte Darmdurchlässigkeit auf. Diese Störungen, die oft durch starken Antibiotika-Einsatz verschlimmert werden, führen zu sehr häufigen Symptomen wie Verstopfung, Diarrhö, Bauchschmerzen, Blähungen, gastroösophagealem Reflux und übel riechenden Stühlen bei Menschen, die von Autismus betroffen sind.
Viele Experen glauben, dass die bei diesen Störungen beobachtete gastrointestinale Pathologie zur Krankheitsprogression beiträgt. So kann eine Dysbiose beispielsweise zur pathogenen Produktion von Neurotoxinen beitragen, die ins Blut gelangen und die Symptome der Autismus-Spektrum-Störung verstärken. Auch können eine eingeschränkte Verdauungsfähigkeit und gestörte Darmbarrierefunktion die Resorption von Antigenen aus der Nahrung ermöglichen, die zu neurologischen Verhaltensanomalien führen.
Die Häufigkeit gastrointestinaler Dysfunktion in dieser Patientengruppe hat dazu geführt, dass viele medizinische Fachkräfte auf Probiotika zurückgreifen, um die gastrointestinalen und neurologischen Verhaltenssymptome autistischer Patienten zu behandeln. Probiotika tragen zur Beseitigung pathogener Mikroben bei, bauen Antigene aus der Nahrung ab, fördern die Entgiftung, reduzieren Entzündungen, verbessern die Darmbarrierefunktion und stellen eine gesunde Darmmikroflora wieder her. Zwar liegen noch keine klinischen Studien dazu vor, doch erste Daten zeigen neuropsychologische Verbesserungen bei Versuchspersonen nach dem Verzehr von Lactobacillus-Präparaten, was darauf schließen lässt, dass Probiotika eine wirksame nahrungsbasierte Intervention bei Patienten mit Autismus-Spektrum-Störungen sein können.
Mundgesundheit
In jüngerer Zeit sind Probiotika als förderlich für die Mundgesundheit erkannt worden. Die Mundhöhle bildet ein Reservoir für Probiotika, insbesondere Laktobazillen und Daten sprechen dafür, dass diese nützlichen Organismen Pathogenen entgegen wirken, die an Karies und Periodontitis beteiligt sind. In Kulturstudien hemmen die Probiotika L. rhamnosus, L. paracasei und B. longum das Wachstum vieler oraler Pathogene wie Streptococcus mutans, S. sanguinis, S. salivarius, S. aureus, Porphyromonas gingivalis und Prevotella intermedia.
Darüber hinaus zeigen klinische Studien mit Kindern und Erwachsenen, dass die Gabe von Probiotika die Häufigkeit von Zahnkaries und Zahnfleischerkrankungen wirksam reduziert. In einer Studie erhielten Personen mit einer periodontitisbedingten Halitose täglich 2 Milliarden koloniebildende Einheiten (kbE) des Probiotikums Lactobacillus salivarius in einer sich langsam auflösenden Tablette. Nach vier Wochen war eine deutliche Reduktion sowohl des Mundgeruchs als auch der beim Sondieren des Zahnfleischs hervorgerufenen Blutung zu beobachten. In einer weiteren Studie verringerte die Anwendung einer topischen Auflage aus Kollagen und L. casei auf dem Zahnfleisch von Personen mit chronischer Periodontitis die Populationen periodontaler Pathogene signifikant und führte zu einer langfristigen Remission der Erkrankung. Eine randomisierte, doppelblinde, placebokontrollierte Studie mit fast 600 Kindern ergab außerdem, dass der Verzehr von mit L. rhamnosus fermentierter Milch nach 7 Monaten im Vergleich zum Verzehr normaler Milch zu einem signifikanten Rückgang der Häufigkeit von Zahnkaries führte.
Probiotische Präparate zur Förderung der Mundgesundheit werden am besten in sich langsam auflösenden Tabletten oder in Kautabletten verabreicht, die den Kontakt der Organismen mit den Geweben der Mundhöhle verlängern.
Modulation von Biofilmen
Biofilme sind komplexe Zusammensetzungen von Mikroorganismen, die in einer Matrix aus extrazellulären polymeren Substanzen eingeschlossen sind. Die Mikroorganismen erzeugen den Biofilm selbst, um sich an Oberflächen anzuheften, sich zu schützen und ihren Fortbestand zu sichern. Im Darm treten Bakterien allgemein frei lebend (planktonisch) oder eingebettet in Biofilmgemeinschaften (sessil) auf. Auch in der Mundhöhle leben die meisten Bakterien in Biofilmgemeinschaften, die als Plaque bezeichnet werden.
Biofilme sind heterogen aufgebaut und bestehen sowohl aus nützlichen als auch aus schädlichen Mikroorganismen. Im Idealfall bilden Biofilme eine symbiotische Beziehung zum Wirt und erlauben gleichzeitig die gesundheitsfördernden Wirkungen der nützlichen Organismen, während sie die Aktivität von Pathogenen einschränken. Störungen im Wirtsmilieu können jedoch zu Änderungen der Biofilm-Zusammensetzung führen, die Wachstum und Virulenz schädlicher Organismen begünstigen und das Erkrankungsrisiko erhöhen.
Eine Nahrungsergänzung durch Probiotika ist vielleicht das direkteste und wirksamste Mittel zum Erhalt gesunder Biofilmgemeinschaften. Zahlreiche Studien zeigen, dass Probiotika in der Lage sind, entweder die Bildung pathogener Biofilme zu stören oder das Wachstum von Pathogenen in Biofilmen zu behindern. Diese Wirkungen sind für B. bifidum, B. infantis, B. longum, L. casei, L. fermentum, L. paracasei, L. plantarum, L. reuteri, L. rhamnosus, L. salivarius, S. boulardii und S. thermophilus gegenüber einer Reihe von Biofilme bildenden Pathogenen wie Candida albicans, Candida tropicalis, E. coli, G. vaginalis, K. pneumoniae, P. aeruginosa, S. aureus und S. mutans beschrieben worden.
Häufige Fragen zu Probiotika
Woher weiß ich, ob (wann) ich ein Probiotikum brauche?
Probiotika können dazu dienen, eine gesunde, ausgeglichene Darmmikroflora zu erhalten. Die heutige Ernährung besteht oft aus sehr stark verarbeiteten, sterilisierten Lebensmitteln, denen es an wichtigen Mikroorganismen wie L. plantarum, L. rhamnosus, L. casei und L. acidophilus fehlt. Diese Organismen müssen verzehrt werden, um dauerhaft im Magen-Darm-Trakt vorhanden zu sein.
Durch Kaiserschnittentbindung geborene Säuglinge und solche, die nicht gestillt werden, weisen häufig eine gestörte Darmmikroflora auf, die sich kurz- und langfristig ungünstig auf die Gesundheit auswirken kann, weshalb sie möglicherweise von Probiotika profitieren.
Mit wachsendem Lebensalter verändert sich auch die Mikroflora, und insbesondere die Zahl der Bifidobakterien nimmt ab. Probiotika können die altersbedingten Verschiebungen im Gleichgewicht der Darmmikroflora möglicherweise korrigieren.
Probiotika können auch parallel zu Antibiotika, Immunsuppressiva und anderen Arzneimitteln eingenommen werden, die das Gleichgewicht der Mikroflora stören.
Zu den gut untersuchten Symptomen, die sich durch Probiotika lindern lassen, zählen die Antibiotika-bedingte Diarrhö sowie andere Formen der Diarrhö, Vaginitis, Laktose-Intoleranz, intestinale und vaginale Dysbiose, Blähungen, Flatulenz und Verstopfung.
Es konnte auch gezeigt werden, dass manche Probiotika Nahrungsmittel-Allergien abmildern und das Immunsystem modulieren.
Wenn bei Ihnen solche Symptome bestehen, ist es am besten, sich mit medizinischen Fachleuten zu beraten, die in der Anwendung von Probiotika erfahren sind.
Welche Probiotika sollte ich einnehmen?
Um diese Frage bestmöglich zu beantworten, sollten Sie sich mit medizinischen Fachleuten beraten, die sich mit der Anwendung von Probiotika auskennen und abschätzen können, welche Probiotika Ihnen am ehesten helfen können. Dabei sollten diese sich von klinischen Berichten und in der medizinischen Fachliteratur veröffentlichten Studienergebnissen leiten lassen und ggf. auch die labortechnische Analyse entsprechender Proben berücksichtigen.
Die folgenden Empfehlungen mögen daher nur erste Anhaltspunkte liefern: So wurde beispielsweise gezeigt, dass L. acidophilus, L. bulgaricus, B. longum und S. thermophilus das Risiko einer Antibiotika-bedingten Diarrhö senken. In mindestens sechs gründlichen klinischen Studien wurde nachgewiesen, dass S. boulardii das Risiko einer Antibiotika-induzierten Diarrhö senkt und vor C. difficile schützt. Einer durch Rotaviren hervorgerufenen Gastroenteritis bei Kindern lässt sich durch L. rhamnosus, L. casei, S. thermophilus und B. bifidum vorbeugen. L. rhamnosus kann nachweislich die Symptome von Lebensmittel-Allergien mildern. Eine Reihe von Laktobazillen wie L. casei, L. delbrueckii, L. helveticus und L. acidophilus sowie Bifidobacterium sind wirksam gegen H. pylori, einen Organismus, der mit peptischen Ulzera in Verbindung gebracht wird. Personen mit Reizdarmsyndrom (RDS) scheint eine Kombination aus Laktobazillen und Bifidobakterien am besten zu helfen. Wer seine Darmmikroflora günstig beeinflussen möchte, nutzt dazu am besten eine umfassende Kombination aus Lactobacillus- und Bifidobacterium-Arten.
Woher weiß ich, ob das Probiotikum mir geholfen hat?
Wenn Symptome vorliegen, ist deren Abklingen oder Verschwinden das beste Zeichen für die Wirkung der Probiotika. Je nach individuellem Ansprechen auf die Probiotika und die Schwere der zugrunde liegenden Erkrankung kann es Tage oder sogar Wochen dauern, bis sich eine solche Verbesserung bemerkbar macht.
Werden Probiotika als allgemeine gesundheitsfördernde Maßnahme angewendet, ohne dass Beschwerden vorliegen, ist deren Nutzen wahrscheinlich nicht offensichtlich.
Lässt sich mein Ansprechen auf Probiotika mit Tests überprüfen?
Abgesehen von bestimmten Ausnahmen wie dem Vorhandensein von C.-difficile-Toxin oder pathogenen Mikroorganismen im Stuhl gibt es keine leicht zugänglichen, zuverlässigen klinischen Laboruntersuchungen, mit denen sich ein „Ansprechen” auf Probiotika überprüfen lässt.
Oft werden aufgrund der Überlegung, dass sich Probiotika im Darm auch im Stuhl zeigen müssten, Stuhlkulturen angefordert. Die meisten Probiotika sind jedoch hinsichtlich ihrer Nährstoff-Anforderungen wählerisch und lassen sich nicht leicht aus routinemäßigen Stuhlproben kultivieren. Eine negative Stuhlkultur für Probiotika-Arten zeigt also nicht an, dass keine Besiedlung erfolgt ist oder dass die Organismen nicht vorhanden seien oder keinen Nutzen entfalten würden.
Zum Nachweis einer probiotischen Besiedlung des Darms werden daher aktuell Darmbiopsien und DNA-Amplifikationsverfahren verwendet.
Haben Probiotika Nebenwirkungen?
In seltenen Fällen bemerken manche Personen eine Verschlechterung ihrer klinischen Beschwerden nach Beginn der Einnahme von Probiotika. Manche schreiben dieses Phänomen einem Absterben der pathogenen Bakterien zu, die dadurch toxische Zellprodukte freisetzen. Der genaue Mechanismus einer solchen vorübergehenden Verschlechterung von Symptomen ist nicht bekannt, aber er kann auftreten.
Die anhaltende Einnahme von Probiotika wird aber meistens durch eine Symptomlinderung belohnt. Bei manchen Personen kann es zu Blähungen, Bauchschmerzen und sogar Diarrhö kommen, die aber in der Regel mit der Zeit verschwinden. Nur in sehr seltenen Fällen waren Probiotika auch die Ursache opportunistischer Infektionen.
Sollte ich ein Probiotikum kaufen, das Präbiotika enthält?
Präbiotika sind Kohlehydrate, die vom menschlichen Darm nicht verdaut werden können, die aber selektiv die Aktivität und das Wachstum bestimmter Bakterien im Dickdarm fördern. Sie haben daher viel Aufmerksamkeit als Mittel zur Vermehrung der Zahl gesunder, nützlicher kommensaler Bakterien im Darm erhalten.
Allgemein sind Probiotika, die mit Präbiotika kombiniert sind (und dann als Synbiotika bezeichnet werden), eine gute Wahl.
Die meisten Präbiotika sind verdauungsresistente Ketten von zwei bis neun Zuckermolekülen (Oligosaccharide). Zu den am weitesten verbreiteten Präbiotika gehören Laktulose, Oligofruktose, Galakto-Oligosaccharide, Soja-Oligosaccharide und das aus Chicorée abgeleitete Inulin. Manche Präbiotika wie Laktulose werden synthetisch hergestellt, wohingegen die meisten anderen Oligosaccharide natürliche Bestandteile von Nahrungsmitteln sind. Sie finden sich allgemein in Chicorée, Spargel, Artischocken, Zwiebeln, Knoblauch, Porree und Sojabohnen sowie in Kuhmilch und Muttermilch. Nach dem Verzehr passieren Präbiotika den Dünndarm und gelangen in den Dickdarm, wo sie selektiv von nützlichen Milchsäure produzierenden Bakterien verwertet werden.
Zahlreiche Studien deuten darauf hin, dass Bifidobakterien kurzkettige Oligosaccharide bevorzugen und jüngere Studien lassen vermuten, dass Oligofruktose, Soja-Oligosaccharide und Galakto-Oligosaccharide am günstigsten für deren Entwicklung sind. Präbiotika können die Zahl der Bifidobakterien im Dickdarm wesentlich steigern und die Population von pathogenen Bakterien wie Klostridien, Fusobakterien und grampositiven Kokken verringern.
Inulin ist ein weit verbreitetes Präbiotikum uas der Gruppe der Polysaccharide, das nicht mit den Blähungen und Flatulenzen assoziiert ist, die für andere Präbiotika manchmal beschrieben werden. Inulin ist für Pathogene schwerer zu metabolisieren und dient — anders als manche stark verarbeiteten kurzkettigen Frukto-Oligosaccharide — eher weniger als Nahrungsquelle für pathogene Bakterien.
Wann und wie sollte ich ein Probiotikum anwenden?
Auf diese Frage werden oft widersprüchliche Antworten gegeben. Selbst die Produktkennzeichnungen verschiedener Probiotika-Hersteller können sich direkt widersprechen: Manche empfehlen, Probiotika mit den Mahlzeiten einzunehmen, andere dazwischen. Auch die medizinische Fachwelt ist sich in diesem Punkt nicht einig.
Diejenigen, die für die Einnahme von Probiotika mit den Mahlzeiten plädieren, begründen dies damit, dass die Nahrung die Magensäure puffert und so die Mikroorganismen schützt. — Diejenigen, die empfehlen, Probiotika ohne Nahrung einzunehmen, raten in der Regel dazu, viel Wasser dazu zu trinken. Das Wasser verdünnt die Magensäure und kann den Mikroorganismen helfen, schnell in den Darm zu gelangen und so den Kontakt mit Magensäure und Gallenflüssigkeit zu minimieren.
Nur wenige Untersuchungen stützen einen der beiden Ansätze direkt. Allerdings sind in zahlreichen Studien Probiotika mit den Mahlzeiten verabreicht und wesentliche Wirkungen beschrieben worden. Am vernünftigsten ist es wahrscheinlich, Probiotika mit einer mäßigen Menge von Speisen einzunehmen, die nicht wärmer als Raumtemperatur sein sollten.
Wann sollte ich ein Probiotikum anwenden, wenn ich Antibiotika nehme?
Früher wurde oft davon abgeraten, Probiotika gleichzeitig mit Antibiotika einzunehmen, da man davon ausging, dass die Antibiotika die aufgenommenen Probiotika abtöten würden. Aber dieser (aus unserer Sicht mittlerweile veraltete) Ansatz erlaubt pathogenen Bakterien eine Vermehrung, die nicht durch nützliche Bakterien begrenzt ist, und die daher häufig zu Antibiotika-bedingter Diarrhö und anderen Problemen führt.
Folglich erscheint es durchaus sinnvoll, Probiotika (auch) während einer antibiotischen Behandlung einzunehmen, und zwar mindestens eine Stunde vor oder zwei Stunden nach der Einnahme des Antibiotikums.
Wie viel sollte ich vom Probiotikum einnehmen?
Die Antwort hängt davon ab, ob das Probiotikum therapeutisch oder einfach zur Bewahrung eines gesunden Gleichgewichts der Darmmikroflora eingesetzt wird. Allgemein ist eine Dosis von ca. 1 Milliarde koloniebildender Einheiten (kbE) erforderlich, um signifikante Mengen lebensfähiger Probiotika bis in den Darm zu bringen. Der Trend geht zu höheren Dosierungen.
Einige kommerzielle Kombi-Probiotika-Präparate werden in Packungen zu je 450 Milliarden Organismen geliefert und sind problemlos in Dosen von bis zu 3,6 Billionen kbE/Tag bei Patienten mit Colitis ulcerosa
eingesetzt worden. In einer klinischen Studie, in der täglich 200 Milliarden Organismen von Klaire Labs® Ther-Biotic® Factor 6 (kommerzielles Gemisch aus sechs probiotischen Arten) an Nierentransplantierte verabreicht wurden, verringerten die Probiotika die Häufigkeit der durch die Immunsuppression bedingten Diarrhö um 73%. Man beachte, dass die Dosis von 200 Milliarden kbE/Tag auch in dieser immunsupprimierten Population unbedenklich war.
Überstehen probiotische Organismen den Kontakt mit Magensäure und Gallenflüssigkeit?
Verschiedene probiotische Organismen sind unterschiedlich empfindlich gegenüber Magensäure und Gallenflüssigkeit. Keinen Einfluss hat Magensäure auf S. boulardii. Milchsäure produzierende Bakterien sind empfindlicher und gedeihen in übermäßig sauren oder alkalischen Milieus nicht gut. Manche Milchsäure produzierende Bakterien wie L. rhamnosus sind empfindlicher als andere.
Die Hersteller von Probiotika haben eine Reihe von Methoden entwickelt, um das Überleben der Probiotika bei oraler Verabreichung zu begünstigen. Manche bieten einen magensaftresistenten Überzug aus Zellulose oder häufig auch aus synthetischen plastifizierten Polymeren an. Letztere werden von empfindlichen Personen häufig nicht vertragen.
Manche Hersteller überziehen die probiotischen Mikroorganismen im Zuge einer „Mikro-Verkapselung” mit gemüsebasierten Fettsäuren. Diese Mikroeinkapselung schützt die Probiotika nicht nur gegen Magensäure, sondern auch gegen Luft und Feuchtigkeit und erhält sie auch bei Raumtemperatur
am Leben. Andere Hersteller (z. B. Klaire Labs®) betten die probiotischen Mikroorganismen in einen hoch gereinigten Extrakt aus Meerespflanzen in einer säurestabilen Technologie ein. Der Extrakt wird mit den Probiotika vermischt, und wenn dieses Gemisch in Kontakt mit Magensäure kommt, bildet es eine gelartige Matrix um die Mikroorganismen, die diese vor der Magensäure schützt.
Bei der Anwendung von Probiotika im Mund-Rachen-Raum, in der Speiseröhre und im Magen ist es angeraten, Probiotika zu wählen, die nicht magensaftresistent gemacht wurden.
Müssen Probiotika dem Darm anhaften, um wirken zu können?
Die Anhaftung an der Darmschleimhaut ist nur eines von vielen Merkmalen, die darüber entscheiden, ob ein Organismus als Probiotikum nützlich sein kann. Diese Anhaftung lässt sich unter Laborbedingungen beobachten. Es gibt Hinweise darauf, dass die normale Darm-Mikroflora häufig nicht an den Epithelzellen des Darms anhaftet, sondern in der Regel im Darminhalt suspendiert lebt oder sich in einem Biofilm befindet, der auf der Schleimschicht liegt.
Nichtsdestotrotz ist solch eine Anhaftung (wie oben beschrieben) sicherlich nicht zwingend nötig, damit ein Probiotikum wirken kann. Es gibt zahlreiche wissenschaftliche und anekdotische Berichte zum therapeutischen Nutzen von Joghurt, obwohl die wichtigsten Bakterien in Joghurtkulturen (v. a. die Stämme S. thermophilus und L. bulgaricus) transiente Mikroorganismen sind, die nicht an der Schleimhaut anhaften.
Demnach ist die Modulation der Immunfunktion durch Probiotika offensichtlich nicht auf eine Anhaftung an der Darmschleimhaut bzw. auf deren Besiedlung angewiesen. Ein Grund hierfür ist, dass Probiotika in aller Regel relativ leicht von spezialisierten Lymphknoten in der Dünndarmwand, den Peyer‘schen Plaques, aufgenommen werden, wo sie die Produktion von IgA, Zytokinen und anderen Mediatoren der Immunfunktion stimulieren. Selbst die Verabreichung abgetöteter Probiotika verbessert nachweislich die Immunfunktion.
Eine Schleimhaut-Besiedlung wurde in vivo nur für wenige probiotische Stämme belegt. Nach oraler Verabreichung ließ sich L. rhamnosus GG in Kulturen aus rektalen Biopsien bis zu 12 Tage lang nachweisen. Trotz sofortiger Verarbeitung war die Empfindlichkeit von Stuhlkulturen eher schlecht. In einer Teilgruppe wurde L. rhamnosus nur in 20% der letzten Stuhlkulturen, aber noch in 88% der rektalen Biopsiekulturen nachgewiesen. In einer weiteren Studie ließen sich Probiotika, die oral an schwerstkranke Patienten unter starker Antibiose verabreicht worden waren, in rektalen Biopsien nachweisen. Eine Gabe von L. plantarum reduzierte die Populationen pathogener Enterobacteriaceae und sulfitreduzierender Klostridien.
In-vivo-Studien zur Darmbesiedlung durch Probiotika haben somit zwei wichtige Erkenntnisse hervorgebracht:
- Die erste Erkenntnis ist, dass routinemäßige Stuhlkulturen zur Beurteilung einer probiotischen Therapie wenig bis gar nicht geeignet sind.
- Die zweite Erkenntnis ist, dass zur Aufrechterhaltung der Besiedlung und des Nutzens eine anhaltende Aufnahme der Probiotika erforderlich ist.
Schadet die Gefriertrocknung Probiotika?
Die Gefriertrocknung oder Lyophilisierung schadet Probiotika nicht, sofern strenge Vorgaben eingehalten werden. Mit solchen anerkannten Herstellungsverfahren lässt sich die Lebensfähigkeit der mikrobiellen Probiotika langfristig gewährleisten. Routinemäßige „Überlebensstudien” prüfen, ob die Probiotika auch nach der Gefriertrocknung noch lebensfähig sind.
Nicht-gefriergetrocknete Probiotika, beispielsweise in flüssiger Form, sind hingegen selbst gekühlt viel kürzer haltbar. Ihre vergleichsweise kurze Haltbarkeit ist durch die Endprodukte von Gärprozessen bedingt, die für die Mikroorganismen toxisch sind. Ein bekanntes Beispiel ist das Absterben von Hefen bei der Produktion von Bier und Wein.
Die Gefriertrocknung unterbindet die Fermentation und verbessert somit die Lebensfähigkeit der Mikroorganismen.
Müssen alle Probiotika kühl gelagert werden?
Allgemein sollten Probiotika gekühlt gelagert und transportiert werden, um ihre Lebensfähigkeit möglichst lange zu erhalten. Dies gilt auch für viele der o. g. gefriergetrockneten probiotischen Präparate, da diese spätestens nach dem Öffnen bzw. „Aufbrechen” ihres (idealerweise) luftdicht versiegelten Verpackungsbehälters mit der Luftfeuchtigkeit in Kontakt kommen.
Die einzige Ausnahme sind mit Fettsäuren mikroverkapselte Probiotika, die keine Kühlung benötigen. Im Einzelhandel erhältliche Probiotika sind oft nicht gekühlt, weshalb es nicht überrascht, dass Branchen- und Verbraucherstudien solcher Produkte gezeigt haben, dass 30 bis 50 Prozent davon deutlich weniger lebensfähige Mikroorganismen enthalten als auf dem Etikett angegeben.
Wenngleich die meisten Probiotika-Präparate aus den o. g. Gründen grundsätzlich bzw. „vorsichtshalber” gekühlt gelagert werden sollten, verderben oder sterben sie bei Raumtemperatur nicht gleich ab. Sie können ohne wesentliche Minderungen der Lebensfähigkeit tage- oder sogar wochenlang bei Raumtemperatur aufbewahrt werden. Allerdings sollten sie nicht länger höheren Temperaturen oder starkem Sonnenlicht ausgesetzt werden.
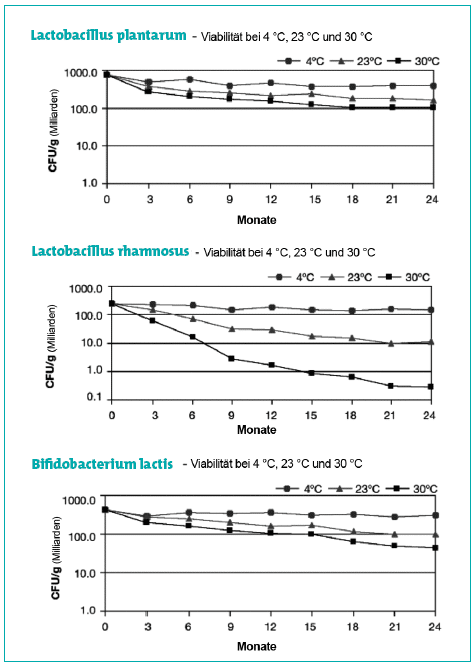
Diagramm 1 zeigt die Lebensfähigkeit ausgewählter Stämme von Probiotika bei Umgebungstemperaturen von 4°C, 23°C und 30°C. Daraus ist ersichtlich, dass diese bei niedrigen Temperaturen besser überleben als bei hohen Temperaturen. Bei Raumtemperatur (23°C) nehmen die Koloniezahlen nach ein bis zwei Monaten ab, was erklärt, warum so viele verschreibungsfreie Probiotika-Produkte aus dem Einzelhandel weniger als die angegebene Menge lebensfähiger Organismen enthalten. Das Diagramm zeigt auch, dass manche Stämme wie L. rhamnosus stärker temperaturempfindlich sind als andere.
Nichtsdestotrotz führt die Aufbewahrung von Probiotika bei Raumtemperatur oder sogar bei höheren Temperaturen für ein paar Stunden oder sogar Tage jedoch nur zu einem geringfügigen Verlust an Organismen. Folglich sollten Probiotika zwar im Idealfall mit Kühlpacks versandt werden, aber dennoch besteht in aller Regel kein Grund zur Sorge, wenn diese Kühlpacks zum Lieferzeitpunkt geschmolzen oder nicht mehr kalt sind.
Ist es wichtig, ob ein Probiotikum in einer Glas- oder einer Kunststoffflasche geliefert wird?
Die meisten Probiotika sind anaerobe Organismen, was bedeutet, dass sie ohne Sauerstoff leben. Ein Kontakt mit Luft (Sauerstoff) ist daher nicht erwünscht oder sogar toxisch für sie. Für die „Lagerfähigkeit” gefriergetrockneter Probiotika ist Feuchtigkeit potenziell noch schädlicher als Luftkontakt.
Es krusiert daher das Argument, dass Probiotika in Glasflaschen verpackt werden sollten, um den Kontakt mit Luft und Feuchtigkeit zu minimieren. Allerdings ist der Unterschied in der Durchlässigkeit zwischen Glas und hochdichtem Polyethylen (HDPE), einem häufig für Flaschen verwendeten Kunststoff, vernachlässigbar. Außerdem gelangen nach dem Öffnen in jedem Fall Luft und Feuchtigkeit in die Flasche, wodurch die relativen Unterschiede in der Durchlässigkeit zwischen Glas- und Kunststoffbehältnissen irrelevant werden. Unabhängig vom Material kann die Zugabe von Trocknungsmitteln zu Behältern mit Probiotika den Feuchtigkeitsgehalt darin minimieren.
Die Verpackung von Probiotika in Glas- oder HDPE-Behältern ist somit gleichermaßen akzeptabel.
Ist es günstig, wenn der Kulturüberstand mit dem Probiotikum kombiniert wird?
Der so genannte Kulturüberstand ist das transformierte Kulturmedium, das bei der Vermehrung von Bakterien entsteht und in das die Bakterien eine Vielzahl von Substanzen abgegeben haben. Milch ist beispielsweise ein Kulturmedium, Joghurt ist ein Kulturüberstand. Mindestens ein Unternehmen gibt an, dass die Vermengung des Kulturüberstands mit den Bakterien zu weiteren gesundheitsfördernden Eigenschaften beiträgt. Dieser Zusatznutzen ist zwar denkbar, aber nicht gut durch Daten belegt. Die Beibehaltung des Kulturüberstands während der Produktion könnte dagegen das Überleben der Probiotika beeinträchtigen, wenn die Nebenprodukte der Fermentation für diese toxisch sind. Der hypothetische Nutzen des Einschlusses des Kulturüberstands scheint somit der negativen Auswirkung auf die Lebensfähigkeit der Probiotika unterlegen zu sein.
Darf man Probiotika bei Säuglingen und Kleinkindern anwenden?
Probiotika sind problemlos und mit nützlicher Wirkung bei Säuglingen und Kleinkindern eingesetzt worden. Die traditionelle Lehrmeinung ist, dass der Darm Neugeborener steril ist und keine Mikroorganismen beherbergt. Seine Besiedelung beginnt also mit der Geburt. Während der ersten Lebenswoche ringen dabei Streptococcus, Clostridium, Bifidobacterium und Lactobacillus um die Vorherrschaft. Am Ende der ersten Woche haben sich üblicherweise Bifidobakterien als dominante Gattung durchgesetzt. Gestillte Säuglinge weisen in der Regel viel höhere Zahlen von Bifidobakterien im Darm auf als nicht gestillte, die höhere Konzentrationen von E. coli und anderen pathogenen koliformen Bakterien haben. Zum Teil ist dies auf das Vorhandensein bifidogener Substanzen in der Muttermilch zurückzuführen.
Auch wenn der Darm der Neugeborenen rasch besiedelt wird, ist er noch nicht voll entwickelt. So können Säuglinge die als D(-) bezeichnete isomere Form der Milchsäure nicht verstoffwechseln. Theoretisch könnte daher ein Kontakt mit D(-)-Milchsäure zu einer D(-)-Milchsäure-Azidose führen, die einen bedrohlichen Zustand darstellt. Zwar liegen keine Berichte über eine D(-)-Milchsäure-Azidose bei Säuglingen aufgrund von Probiotika vor und D(-)-Milchsäure produzierende Probiotika wie L. acidophilus und L. plantarum sind ohne Probleme bei Säuglingen angewendet worden, dennoch sollten für Säuglinge vorgesehene Probiotika nur Arten enthalten, die primär oder ausschließlich das L(+)-Isomer der Milchsäure produzieren.
Der Nutzen und die Unbedenklichkeit von Probiotika bei Säuglingen wurden in klinischen Studien belegt: In einer Placebo-kontrollierten Studie erhielten Säuglinge und Kleinkinder im Alter von 3 bis 24 Monaten über 7 Monate hinweg täglich durchschnittlich je 41 Millionen kbE oder 3,7 Millionen kbE B. lactis und S. thermophilus pro Kilogramm in einer normalen milchbasierten Nahrung. Die Probiotika wurden gut vertragen. Die damit behandelten Säuglinge und Kleinkinder zeigten ein angemessenes Wachstum, hatten weniger Koliken oder Darmreizungen und brauchten weniger häufig Antibiotika. In einer anderen Studie senkte ein probiotischer Zusatz von 190 Millionen kbE B. bifidum und 14 Millionen kbE S. thermophilus pro Gramm Nahrung die Häufigkeit akuter Diarrhö und der Ausscheidung von Rotaviren während Krankenhaus-Aufenthalten. Mindestens drei weitere Studien haben gezeigt, dass eine frühzeitige Gabe von Milchsäure produzierenden Bakterien wie L. acidophilus, L. casei, B. breve, B. infanti und S. thermophilus die Häufigkeit und Schwere einer nekrotisierenden Enterokolitis bei Säuglingen mit normalem und niedrigem Geburtsgewicht signifikant reduziert. Darüber hinaus konnte in mehreren klinischen Studien gezeigt werden, dass eine Nahrungsergänzung durch Probiotika bei Säuglingen und Kleinkindern hoch wirksam zur Vorbeugung oder Behandlung allergischer Ekzeme ist.
Weitere allgemeine Anmerkungen und zusammenfassende Schlussfolgerungen
Probiotika werden seit Jahrtausenden, nämlich seit dem ersten Verzehr fermentierter Milchprodukte, vom Menschen genutzt. Probiotika können für die normale Verdauungsfunktion sowie die endokrine und immunologische Funktion des Darms unerlässlich sein. Sie hemmen pathogene Mikroorganismen und sind therapeutisch zur Behandlung einer Vielzahl gastrointestinaler und sogar systemischer Störungen eingesetzt worden.
Probiotika besiedeln den Darm nur vorübergehend und müssen daher, sofern sie nicht der Behandlung einer akuten Erkrankung dienen, regelmäßig verzehrt werden, um ihren Nutzen aufrechtzuerhalten. Die Auswahl geeigneter Probiotika, die einzeln oder in Kombination angewendet werden können, erfolgt am besten in der Beratung durch erfahrene medizinische Fachleute.
Probiotika sind außergewöhnlich sicher in der Anwendung
Hintergrund
Menschen verzehrten mikrobiell fermentierte Nahrung bereits vor Beginn der Geschichtsschreibung und tun dies auch heute noch ohne Probleme. Lebende Bakterien- oder Hefekulturen werden seit langem zur Herstellung von Lebensmitteln wie Joghurt, Kefir, Sauerkraut, Kimchi und Miso eingesetzt.
Zu Beginn des 20. Jahrhunderts beobachteten Wissenschaftler, dass der Verzehr fermentierter Nahrungsmittel sich günstig auf die Gesundheit auswirkte, und entwickelten das Konzept der Probiotika: lebende Mikroorganismen, die bei regelmäßigem Verzehr einen gesundheitlichen Nutzen haben. Seit der Einführung dieses Konzepts sind zahlreiche Arbeiten zum Nachweis der gesundheitsfördernden Wirkung von Probiotika erschienen, die von der Verbesserung des gastrointestinalen Wohlbefindens bis zu einer Stärkung der systemischen Immunfunktion reichen. Heute sind gut untersuchte Probiotika wie Organismen der Gattungen Lactobacillus, Bifidobacterium und Saccharomyces als funktionelle Inhaltsstoffe von Lebensmitteln und Nahrungsergänzungsmitteln weit verbreitet und haben ein ausgezeichnetes Wirksamkeits- und Sicherheitsprofil.
Forschung zur Sicherheit — Epidemiologische und klinische Daten
Studien haben gezeigt, dass Probiotika nicht nur gesundheitsförderlich sondern auch außergewöhnlich sicher in der Anwendung sind. In Toxizitätsstudien an Tieren konnten keine unerwünschten Ereignisse als Folge der Anwendung von Probiotika nachgewiesen werden, und die Ergebnisse der Forschung am Menschen fallen ähnlich aus. Die größte Befürchtung beim Verzehr lebender Mikroorganismen ist die Entstehung einer Sepsis, aber Bakteriämien aufgrund von Lactobacillus- oder Bifidobacterium-Organismen sind extrem selten. Epidemiologische und klinische Forschungsarbeiten sprechen dafür, dass der Gebrauch von Probiotika nicht zu einem häufigeren Auftreten opportunistischer Infektionen führt.
Eine zwischen 1989 und 1992 in Finnland durchgeführte bevölkerungsbasierte Studie stellte fest, dass in Fällen von Bakteriämie nur 8 von 3.317 (d. h., nur 0,2%) Blutkulturen Laktobazillen als verursachende Organismen enthielten. Sequenzanalysen des 16S-rRNA-Gens ergaben, dass die nachgewiesenen Laktobazillen nicht der kurz zuvor eingeführten probiotischen Art Lactobacillus rhamnosus ähnelten, was darauf schließen lässt, dass endogene Darmbakterien die Quelle für die Bakteriämie waren. Eine wesentlich größere Nachfolgestudie konnte für die Jahre von 1995 bis 2000 in Finnland trotz des dort rasch ansteigenden Gebrauchs von L. rhamnosus keinen Anstieg der lactobacillus-assoziierten Infektionen beobachten. Das Hintergrundniveau der Lactobacillus-Bakteriämien blieb stabil und lag weiterhin bei etwa 0,2 % der positiven Blutkulturen.
In drei weiteren Sicherheitsstudien ergaben sich keine Belege für Infektionen infolge der Einnahme von Probiotika. In einer dieser Studien wurde entweder Lactobacillus reuteri oder ein Placebo an 39 Personen mit einer HIV-Infektion verabreicht. Nach drei Wochen wurden als einzige „Nebenwirkungen” gastrointestinale Beschwerden wie Blähungen und Übelkeit angegeben, die in etwa gleich häufig in der Probiotikum- und in der Kontrollgruppe auftraten. In zwei weiteren Sicherheitsstudien wurden Bifidobacterium- und Lactobacillus-Probiotika an Säuglinge mit extrem geringem Geburtsgewicht und an stationär behandelte Kinder verabreicht. Nur bei 2 der 94 im Rahmen dieser Studien Behandelten kam es zu leichten gastrointestinalen Störungen, die sich auf die Maisstärke in den Probiotikapräparaten zurückführen ließen, nicht auf die probiotischen Organismen selbst.
Desweiteren wurden in einer großen Übersichtsarbeit (Meta-Studie) von 1999 die Daten aus 143 einzelnen klinischen Studien zusammengefasst, in denen Probiotika an insgesamt 7.526 Personen verabreicht wurden. Unter den Behandelten waren alle Altersgruppen von frühgeborenen Säuglingen bis hin zu älteren Erwachsenen vertreten, sowie gesunde und chronisch erkrankte Personen. In keiner der Studien, die sich insgesamt über vier Jahrzehnte erstreckten, wurde auch nur ein einziges unerwünschtes Ereignis gemeldet.
In einer anderen, 2010 veröffentlichten Übersichtsarbeit wurden die Ergebnisse einer anderen Reihe klinischer Prüfungen untersucht, in denen Probiotika an Personen mit verschiedenen gesundheitlichen Beeinträchtigungen verabreicht wurden, die eine enterale oder parenterale Ernährung erhielten. Von den 53 betrachteten Studien berichtete keine über eine Zunahme der infektiösen Komplikationen. Nur zwei dieser Studien meldeten ein höheres Niveau nicht infektiöser Ereignisse nach dem Einsatz von Probiotika. Die Ergebnisse dieser beiden Studien muss man näher betrachten:
In der ersten Studie, in der Personen mit akuter Pankreatitis behandelt wurden, führte ein Randomisierungsfehler dazu, dass mehr Personen mit schwererer Erkrankung Probiotika erhielten. Die Studiendaten zeigen, dass in der Probiotikagruppe 9 Personen vor der Randomisierung bereits ein Organversagen erlebt hatten, wohin gegen das nur bei 5 Personen in der Kontrollgruppe der Fall war. Auch war es bei 5 Personen in der Probiotikagruppe bereits vor der Randomisierung zu einem Multiorganversagen gekommen, in der Kontrollgruppe dagegen nur bei 1 Person. In einer Zwischenanalyse stellte eine unabhängige Sicherheitskommission fest, dass dieser Randomisierungsfehler die Mortalitätsdaten verzerrt hatte, sodass scheinbar mehr Personen in der Probiotikagruppe verstorben waren, aber die Studie wurde dennoch fortgesetzt. Die Autoren schreiben, dass eine logistische Regression durchgeführt wurde, um den Randomisierungsfehler rechnerisch zu korrigieren, aber sie geben die entsprechenden Daten in der Veröffentlichung nicht an.
In der zweiten Studie wurden Lebertransplantierte untersucht, die 14 Tage lang entweder Probiotika und Ballaststoffe („Interventionsarm”) oder nur Ballaststoffe („Kontrollarm”) erhielten. Am Ende des Studienzeitraums war es in der Probiotikagruppe zu einer deutlichen und signifikanten Abnahme der Häufigkeit postoperativer Infektionen gekommen. Obwohl mehr Personen in der Probiotikagruppe nicht infektiöse Komplikationen wie Gallengangstenosen meldeten, stellen die Autoren nicht klar, ob die Häufigkeit der unerwünschten Ereignisse in dieser Gruppe signifikant höher war als in der Kontrollgruppe.
Angesichts der methodischen Schwächen der o. g. ersten Studie und der uneindeutigen Angaben der o. g. zweiten Studie ist es wahrscheinlich, dass die beobachteten Zunahmen unerwünschter Ereignisse zufällige Anomalien waren. Schließt man diese Studien als Ausreißer aus, zeigen die zusammengefassten Ergebnisse der Meta-Analysen von 1999 und 2010, dass die Verabreichung von Probiotika in insgesamt 194 klinischen Prüfungen nicht zu unerwünschten Ereignissen führte.
Diese insgesamt außerordentliche Produktsicherheit wird auch durch einen Bericht gestützt, den die Agency for Healthcare Research und Quality (AHRQ, Abteilung für Forschung und Qualität im Gesundheitswesen der US-Gesundheitsbehörde Department of Health and Human Services) 2011 veröffentlichte: In dem umfassenden Bericht werden Daten aus mehr als 600 veröffentlichten Artikeln zu Probiotika aus einem Dutzend medizinischer und gesundheitsbezogener Datenbanken ausgewertet. Von den ursprünglich in diese Übersichtsarbeit aufgenommenen Artikeln schlossen die Forscher 235 Publikationen aus, da diese nur allgemeine Aussagen zur Sicherheit enthielten wie „die Intervention wurde gut vertragen“. Bei den verbleibenden Arbeiten handelte es sich um kontrollierte, randomisierte, klinische Prüfungen, die bestimme Sicherheitsparameter untersuchten und Angaben zu spezifischen unerwünschten Ereignissen machten. In allen diesen Prüfungen zusammen gab es laut Bericht keine Belege für eine Zunahme unerwünschter Ereignisse in den Probiotikagruppen im Vergleich zu den Kontrollgruppen, und zwar weder hinsichtlich der Zahl der Teilnehmenden mit unerwünschten Ereignissen (121 klinische Prüfungen) noch hinsichtlich der in den Behandlungsgruppen gemeldeten Zahlen von unerwünschten Ereignissen (208 klinische Prüfungen).
Weiterhin gibt der oben erwähnte Bericht der AHRQ für die darin berücksichtigten klinischen Prüfungen zusammenfassend an, dass es „keine Hinweise darauf gab, dass es bei den Teilnehmenden, die probiotische Organismen verwendeten, zu statistisch signifikant mehr gastrointestinalen […] Infektionen […] oder anderen unerwünschten Ereignissen kam […] als bei den Teilnehmenden in den Kontrollgruppen.“ Eine weitere wichtige Beobachtung war (Zitat): „Über alle Studien hinweg gab es keine Hinweise darauf, dass es bei ernsthaft Erkrankten und Teilnehmenden mit hohem Risiko mit größerer Wahrscheinlichkeit zu unerwünschten Ereignissen kam, als bei Teilnehmenden in den Kontrollgruppen mit vergleichbarem Gesundheitszustand.“
Die Ergebnisse des AHRQ-Berichts bestätigen die Ergebnisse der epidemiologischen Untersuchungen aus Finnland, der drei veröffentlichten Sicherheitsstudien und der Metaanalysen von 1999 und 2010. Zusammengenommen stellen diese wissenschaftlichen Dokumente eine äußerst umfangreiche, fast unwiderlegbare Beweislage zugunsten der Unbedenklichkeit der Anwendung von Probiotika in der klinischen Umgebung zur Gesundheitsförderung oder Krankheitsbehandlung dar.
Fallberichte
Trotz des ausgezeichneten Sicherheitsprofils in epidemiologischen und klinischen Studien finden sich in der medizinischen Literatur mehrere Fallberichte zu unerwünschten Ereignissen nach der Verabreichung von Probiotika.
Die meisten dieser negativen Ereignisse standen im Zusammenhang mit der Anwendung des pilzlichen Probiotikums Saccharomyces boulardii bei schwer erkrankten Personen mit zentralen oder peripheren Venenkathetern. Das wichtigste gemeldete unerwünschte Ereignis war eine Fungämie. Verweilkatheter sind bekannte Risikofaktoren für Infektionen, da deren Besiedlung durch indigene Mikrobiota oder Umweltkontaminanten dazu führen kann, dass Mikroorganismen (und zwar sowohl pathogene als auch probiotische) in den Blutkreislauf gelangen. Obwohl S. boulardii seit mehr als 60 Jahren über ein ausgezeichnetes Sicherheitsprofil und eine bemerkenswerte belegte Wirksamkeit für die Behandlung verschiedener Formen der Diarrhö verfügt, lässt die Mehrzahl aller Beobachtungen aus einzelnen Fallberichten vermuten, dass dieses spezielle Probiotikum nicht an Personen verabreicht werden sollte, bei denen zentrale oder periphere Venenkatheter oder andere Gefäßzugänge liegen.
Einige wenige Fallberichte bringen auch das Probiotikum L. rhamnosus GG mit bakteriämischen Komplikationen bei Personen mit gesundheitlichen Beeinträchtigungen in Verbindung. Auch hier waren in den meisten Fällen zentrale Venenkatheter vorhanden, die wahrscheinlich zur Ausbreitung der Infektion
beitrugen. Zwar ist eine Bakteriämie eine extrem seltene Komplikation des Probiotikagebrauchs, aber medizinische Fachkräfte sollten Vorsicht walten lassen, wenn sie L. rhamnosus an Personen verabreichen, die einen zentralen oder peripheren Venenkatheter benötigen.
Sicherheit während der Schwangerschaft
Medikamentöse Behandlungen jeglicher Art können in der Schwangerschaft aufgrund der möglichen Schädigung des sich entwickelnden Fötus problematisch sein. Auch wenn Nahrungsergänzungsmittel wie
Probiotika allgemein viel unbedenklicher sind als viele der am häufigsten verwendeten Medikamente, sollten deren schwangerschaftsbezogene Sicherheitsdaten gesondert von anderen Sicherheitsrisiken, die unabhängig von einer Schwangerschaft vorliegen können, untersucht werden.
Probiotika können Schwangeren vaginal oder oral verabreicht werden. Eine Cochrane-Übersichtsarbeit aus dem Jahr 2007 kam zu dem Schluss, dass die vaginale Anwendung probiotisch fermentierten Joghurts während der Schwangerschaft die Inzidenz genitaler Infektionen um 80% verringert. Infektionen im Genitalbereich sind eine Hauptursache für Frühgeburten, die für über 70 % der neonatalen und postnatalen Morbidität und Mortalität verantwortlich sind. Eine neuere Studie fand heraus, dass Schwangere, die täglich etwa 85 Gramm eines probiotikahaltigen Joghurts verzehren, ein signifikant geringeres Risiko spontaner Frühgeburten haben. Diese Daten sind zwar nur vorläufig, deuten jedoch darauf hin, dass die vaginale und orale Verabreichung von Probiotika in der Schwangerschaft nicht nur unbedenklich ist, sondern eine therapeutische Strategie zur Vermeidung von vorzeitigen Wehen und Frühgeburten darstellen kann.
Auch andere Gesundheitsnutzen für Schwangere durch Probiotika sind bereits beschrieben worden: Eine im Jahr 2008 im British Journal of Nutrition veröffentlichte Studie kam zu dem Schluss, dass der Beginn einer probiotischen Nahrungsergänzung und Ernährungsberatung im ersten Schwangerschaftsdrittel zu einer wesentlich besseren Einstellung des mütterlichen Blutzuckerspiegels führt als dies durch eine Ernährungsberatung allein zu erreichen war. Eine Studie aus der Zeitschrift Pediatrics gab an, dass der Gebrauch von Probiotika während der Schwangerschaft in Kombination mit der Verabreichung von sowohl Probiotika als auch Präbiotika an Säuglinge und Kleinkinder die Inzidenz von Atemwegsinfekten in den ersten beiden Lebensjahren signifikant reduziert. Eine wegweisende klinische Studie untersuchte 2001 die Auswirkungen der Gabe des Probiotikums L. rhamnosus sowohl an Schwangere mit einer familiären Vorbelastung für Neurodermitis als auch an deren Säuglinge nach der Geburt.
Nach zwei Jahren war eine Neurodermitis bei Kindern, die das Probiotikum erhalten hatten, nur halb so oft aufgetreten wie bei Kindern, die ein Placebo bekommen hatten. Nachbeobachtungen zu dieser Studie zeigten eine bemerkenswerte Dauerhaftigkeit dieses probiotischen Effekts. Nach vier Jahren war es bei 14 der 53 Kinder in der L.-rhamnosus-Gruppe zu einer Neurodermatitis gekommen, in der Placebogruppe waren es 25 von 54 Kindern (relatives Risiko 0,57). Nach sieben Jahren war das kumulative Risiko für eine Neurodermitiserkrankung in der L.-rhamnosus-Gruppe immer noch signifikant niedriger als in der Placebogruppe (relatives Risiko = 0,64). Fachleute gehen daher davon aus, dass sich die in dieser und anderen Studien beobachteten günstigen Wirkungen auf die Fähigkeit von Probiotika zurückführen lassen, die Immunfunktion zu regulieren, pathogenen Mikroorganismen entgegenzuwirken, die Darmbarrierefunktion zu stärken und Entzündungsprozesse zu modulieren.
Sicherheit während der Stillzeit
Auch bei Säuglingen mit Neurodermitis, deren Mütter in der Stillzeit mit der Einnahme von Probiotika beginnen, ist ein klinischer Nutzen feststellbar. Die Einnahme von Probiotika während der Stillzeit fördert
möglicherweise die Produktion und Ausscheidung von immunprotektiven Wirkstoffen wie Immunglobulin A (IgA) in den Milchdrüsen, wodurch eine stärkere Immunkompetenz an Säuglinge übertragen werden kann.
Eine finnische Studie untersuchte 1997 die Auswirkung der Verabreichung von täglich 40 Milliarden kbE L. rhamnosus an stillende Mütter von Säuglingen mit Neurodermitis. Nach einem Monat zeigte sich eine
signifikante Abnahme der Entzündungssymptomatik bei den Säuglingen, deren Mütter das Probiotikum Lactobacillus erhalten hatten. Eine neuere Studie dokumentierte signifikante Rückgänge der gastro-intestinalen Störungen und des Medikamenteneinsatzes bei gesunden gestillten Säuglingen nach der Verabreichung von Lactobacillus casei an die stillenden Mütter. In keiner der veröffentlichten Studien zur Verabreichung von Probiotika an stillende Mütter sind unerwünschte Ereignisse bei Mutter oder Kind gemeldet worden.
Sicherheit bei der Einnahme bzw. Verabreichung von Probiotika während der frühen Kindheit (Säuglings- und Kleinkindzeit)
Die direkte Verabreichung von Probiotika an Säuglinge, einschließlich Säuglingen mit niedrigem Geburtsgewicht oder sehr niedrigem Geburtsgewicht, scheint nicht i. A. nicht nur unbedenklich sondern sogar sehr förderlich zu sein. Probiotika begünstigen hierbei die Besiedlung des frühkindlichen Darms mit nützlichen Organismen, hemmen Wachstum und Aktivität von Pathogenen, verbessern die Funktion und Integrität der Darmschleimhaut-Barriere und modulieren Immunreaktionen auf positive Weise.
Eine neuere Studie zeigte, dass die ergänzende Gabe von Probiotika an Säuglinge mit niedrigem Geburtsgewicht signifikant Unverträglichkeiten bei der Nahrungsaufnahme reduziert und die Gewichtszunahme verbessert. Es konnte auch nachgewiesen werden, dass Probiotika das Risiko einer nekrotisierenden Enterokolitis wirksam senken, die eine Hauptursache für Morbidität und Mortalität bei Säuglingen mit niedrigem und sehr niedrigem Geburtsgewicht ist. Eine Metaanalyse von 7 randomisierten, kontrollierten, klinischen Prüfungen kam 2007 zu dem Schluss, dass eine frühzeitige Intervention mit Probiotika bei Säuglingen mit sehr niedrigem Geburtsgewicht die Häufigkeit der nekrotisierenden Enterokolitis und die Gesamt-Sterblichkeit signifikant verringert. Eine Aktualisierung
dieser Metaanalyse bestätigte und erweiterte 2010 diese Ergebnisse. In dieser Übersichtsarbeit wurden Daten aus 11 klinischen Studien untersucht, die zwischen 1997 und 2009 mit mehr als 2.000 Säuglingen mit sehr niedrigem Geburtsgewicht durchgeführt worden waren.
Unter Verwendung eines Modells mit fixen Effekten zeigte die Meta-Analyse eine Verringerung der Häufigkeit einer nekrotisierenden Enterokolitis nach einer klinischen Intervention mit Probiotika um 65%. Eine striktere Sequenzanalyse der Prüfungen ergab eine Reduktion um mindestens 30%. Wichtig hierbei ist auch, dass die Probiotika von allen Säuglingen in den Studien gut vertragen und keine unerwünschten Ereignisse gemeldet wurden.
Resistenz gegenüber antimikrobiellen Substanzen
Das Auftreten von Resistenzen gegenüber antimikrobiellen Substanzen bei pathogenen Organismen ist zu einer wesentlichen Hürde für erfolgreiche antimikrobielle Behandlungen geworden. Diese Resistenzen sind ein immer weiter um sich greifendes globales Phänomen, das inzwischen die wirksame Behandlung vieler schwerer und weit verbreiteter Infektionskrankheiten wie Tuberkulose, Malaria, HIV, nosokomialen Infektionen, Shigellose und Gonorrhö gefährdet.
Der übermäßige oder nicht fachgerechte Gebrauch von Antibiotika und antimikrobiellen Wirkstoffen ist eine der Hauptursachen für die Entstehung von Resistenzen bei Pathogenen. Außerdem können Mikroorganismen genetisches Material untereinander austauschen, was die Übertragung der Resistenzen von einer Art auf eine andere erleichtert. Da gezeigt werden konnte, dass auch im Magen-Darm-Trakt angesiedelte Mikroorganismen genetisches Material übertragen, sind Bedenken hinsichtlich einer möglichen Ausbildung von Antibiotikaresistenzen bei probiotischen Organismen geäußert worden, die anschließend auf pathogene Mikroben übertragen werden könnten.
Zwar ist die Fähigkeit probiotischer Arten, solche Resistenzen zu erwerben, bisher kaum untersucht worden; es ist jedoch bekannt, dass Mikroorganismen der probiotischen Gattungen Lactobacillus, Bifidobacterium, Lactococcus, Leuconostoc, Pediococcus und Enterococcus natürlicherweise eine starke Resistenz gegenüber antimikrobiellen Wirkstoffen besitzen. Die inhärente Resistenz bei probiotischen Organismen ist also sehr variabel und artabhängig, aber abgesehen von einigen wenigen Ausnahmen
(insbesondere bei den Enterokokken) zeigen Probiotika üblicherweise keine mehrfachen Arzneimittelresistenzen.
Einige Tierversuche und in-vitro-Studien deuten auch darauf hin, dass probiotische Organismen in ihrer natürlichen Umgebung (wie dem Magen-Darm-Trakt) Resistenzen entwickeln können, wenn sie regelmäßig mit Antibiotika in Kontakt kommen. Solche erworbenen Resistenzen bei Probiotika scheinen jedoch instabil zu sein und nicht erhalten zu bleiben, wenn der Kontakt mit den Antibiotika endet. Abgesehen davon bedeutet weder eine inhärente noch eine vorübergehende erworbene Resistenz bei Probiotika, dass sie diese Resistenzen auch über Plasmide oder andere mobile genetische Elemente auf pathogene Mikroben übertragen könnten. Bisher deuten nur sehr wenige Daten darauf hin, dass manche Probiotika-Stämme Resistenzgene auf pathogene Mikroben übertragen können. Nur eine Studie beobachtete für einen bestimmten Stamm von L. reuteri (DSM 20016), der in gnotobiotische (keimfrei aufgezogene) Mäuse implantiert worden war, dass er ein mit Resistenzen gegen antimikrobielle Substanzen assoziiertes Plasmid namens pAM beta 1 an das Pathogen Enterococcus faecalis übertragen kann. Eine weitere Studie zeigte, dass Lactococcus lactis ebenfalls das Plasmid pAM beta 1 im Magen-Darm-Trakt der Maus auf E. faecalis übertragen kann. Im Gegensatz dazu konnte festgestellt werden, dass L. rhamnosus nicht in der Lage ist, seine inhärente Vancomycinresistenz auf Enterokokkenarten zu übertragen und auch keine Resistenzen von Enterokokken übernimmt.
Solche präklinischen Daten sind zwar von wissenschaftlichem Interesse, müssen aber stets vor dem Hintergrund betrachtet werden, dass die seit mehr als einem Jahrhundert gesammelten Beobachtungsdaten, die epidemiologischen Studien und die klinischen Belege dafür sprechen, dass Probiotika die Virulenz und Infektiosität von Pathogenen eher mindern als steigern, denn: Probiotika konkurrieren mit pathogenen Keimen um Nährstoffe und Lebensraum, produzieren Bakteriozine und andere für Pathogene toxische Substanzen, belegen die für das Pathogenwachstum erforderlichen Nährstoffe und stören die Bildung schützender pathogener Biofilme. So hat sich in zahlreichen randomisierten, kontrollierten, klinischen Studien in den vergangenen Jahrzehnten immer wieder gezeigt, dass Probiotika die Infektionsraten sowohl bei Gesunden als auch bei Personen mit beeinträchtigter Gesundheit wirksam senken. Angesichts dieser überwältigenden Beweislage gibt es keine Hinweise darauf, dass der Erwerb oder die mögliche Übertragung von Resistenzmerkmalen von Probiotika auf Pathogene etwaige Sicherheitsbedenken rechtfertigt.
Sicherheit von Probiotika aus der Gattung Lactobacillus, Bifidobacterium und Bacillus
Bakterienkulturen der Gattungen Lactobacillus und Bifidobacterium zählen zu den am häufigsten eingesetzten und allgemein recht gut untersuchten Probiotika. Auch für etliche andere Bakterien konnten jedoch probiotische Eigenschaften nachgewiesen werden, die in manchen Fällen möglicherweise sogar günstiger sind als die beiden o. g. „traditionellen” Arten von Probiotika.
Angehörige der Gattung Bacillus kommen üblicherweise in Böden und Wassersäulen der natürlichen Umwelt vor, können aber auch im Darmtrakt von Tieren und Menschen überleben und sich dort vermehren. Ein möglicher Vorteil der Bacillus-Organismen besteht darin, dass sie Sporen bilden können, die natürlicherweise sehr robust und widerstandsfähig gegen äußere Einwirkungen sind. Unter ungünstigen Bedingungen wie langer Lagerung bei Raumtemperatur und Passage der Magensäurebarriere überleben solche Sporen in der Regel besser als metabolisch aktive Zellen.
Präklinische Studien zeigen, dass Sporen der Bacillus-Art B. subtilis sehr widerstandsfähig gegenüber künstlichem und natürlichem Magensaft sind. Erste Untersuchungen am Menschen haben ebenfalls gezeigt, dass die Verabreichung von Organismen der Art B. coagulans mehrere gesundheitsfördernde Wirkungen wie eine verstärkte Immunantwort auf Virusinfektionen sowie die Linderung der Beschwerden bei rheumatoider Arthritis und Reizdarmsyndrom (RDS) hat.
Probiotische Produkte, die Bacillus-Organismen enthalten, sind früher häufig falsch gekennzeichnet worden, was möglicherweise auf ein schlechtes Verständnis der taxonomischen Nomenklatur, auf das Fehlen geeigneter analytischer Verfahren, auf uneindeutige Kennzeichnungsvorschriften oder sogar auf absichtliche Täuschungen zurückzuführen war. So wird beispielsweise in den Vereinigten Staaten B. coagulans immer noch häufig als Lactobacillus sporogenes bezeichnet, was keine gültige Artbezeichnung darstellt.
In Europa und anderen Ländern fanden sich in Produkten, die eine bestimmte Bacillus-Art enthalten sollten, oftmals auch andere Bacillus-Arten. Manche Produkte enthielten bzw. enthalten beispielsweise Organismen, die als nicht anerkannte Bacillus-Arten gekennzeichnet sind, wie „B. polyfermenticus“.
Die Verwirrung, die sich aus der langfristigen und immer noch verbreiteten Fehlbenennung von Bacillus-Probiotika ergibt, hat zu berechtigten Zweifeln hinsichtlich der Unbedenklichkeit dieser Produkte geführt, da es ja durchaus möglich ist, dass ein Produkt, das eine falsch bezeichnete Bakterienart enthält, tatsächlich auch unbekannte, möglicherweise schädliche lebende Organismen enthält. Glücklicherweise erlauben die Fortschritte in den Verfahren zur Gensequenzierung inzwischen die korrekte Identifizierung von Bacillus-Organismen, sodass vertrauenswürdige Hersteller von Bacillus-Probiotika in der Lage sein sollten, ihren Kunden ein Analysezertifikat vorzulegen, das die korrekte Bezeichnung der Art bestätigt.
Eine weitere Quelle für Bedenken ist die nachgewiesene Pathogenität zweier Bacillus-Arten, nämlich B. anthracis und B. cereus. B. anthracis ist der hoch pathogene Verursacher des Milzbrands (auch als Anthrax bekannt), während B. cereus eine Reihe opportunistischer Infektionen einschließlich verschiedener Formen der mit Diarrhö und Erbrechen verbundenen Gastroenteritis verursachen kann. Vor 2002 war B. cereus in Europa als Probiotikum für Tierfutter weit verbreitet, wurde aber vom Markt genommen, als seine Toxigenität sich verdeutlichte. Beunruhigenderweise ist B. cereus auch heute noch in manchen für den Menschen gedachten Probiotika zu finden, die natürlich gemieden werden sollten.
B. subtilis wird seit langem in der Fermentation zur Produktion von „Natto“ eingesetzt, einem traditionellen japanischen Sojaprodukt mit hohem Vitamin-K2-Gehalt, sowie bei der Produktion des fibrinolytischen Enzyms Nattokinase. B. subtilis produziert keine Enterotoxine und zeigt auch keine der Virulenzfaktoren, die bei den schädlichen Bacillus-Arten zu finden sind. Toxizitätsstudien mit Tieren haben weder bei akuter noch bei chronischer Verabreichung Anzeichen einer Pathogenität ergeben. Desweiteren haben Studien an Kulturen mit mehreren Unterarten gezeigt, dass B. subtilis auch das Wachstum von Lactobacillus-Arten wie L. acidophilus und L. reuteri fördert. Außerdem produziert B. subtilis eine breite Palette antimikrobieller Substanzen gegen Pathogene wie Helicobacter pylori. In mehreren russischen Studien hat sich gezeigt, dass die Gabe von B. subtilis die Ausheilung resistenter Harnwegsinfektionen bei stationär behandelten Patienten beschleunigt.
Auch das Bakterium B. coagulans ist umfassend auf seine probiotischen und gesundheitsfördernden Wirkungen beim Menschen untersucht worden. Dieser Organismus produziert bakteriozinähnliche Substanzen wie Koagulin und Laktosporin, die pathogene Wirkungen hemmen können. Wie bereits angemerkt, wurde in klinischen Studien gezeigt, dass B. coagulans eine immunfördernde Wirkung
hat und die mit Arthritis und RDS einhergehenden Beschwerden lindern kann. In Sicherheitsstudien mit Tieren zeigte B. coagulans keine Toxizität und ist aktuell die einzige Bacillus-Art, die in den USA mit dem Status GRAS (Abk. für Generally Recognized As Safe, also allgemein als unbedenklich anerkannt) eingestuft ist.
Es ist also sorgfältig darauf zu achten, dass die jeweiligen Arten korrekt identifiziert und nur nachgewiesenermaßen unbedenkliche bzw. gesundheitsförderliche Bacillus-Probiotika verwendet werden.
Sicherheit von Probiotika aus der Gattung „E. coli Nissle 1917”
Escherichia coli Nissle 1917 ist ein einzigartiger nützlicher Escherichia-Stamm, dem die Virulenz und Pathogenität fehlen, für die andere E.-coli-Serotypen bekannt sind.
Historischen Berichten zufolge wurde E. coli Nissle 1917 erstmals aus Proben von einem Soldaten aus dem Ersten Weltkrieg isoliert, der gegen einen Ausbruch ansteckender Diarrhö immun war. Später wurde der Organismus in Europa als Prophylaktikum gegen gastrointestinale Infektionen vermarktet, und in jüngerer Zeit wird er immer häufiger als Probiotikum eingesetzt.
In vitro schwächt E. coli Nissle 1917 die invasiven Fähigkeiten schädlicher Mikroorganismen und unterdrückt die Biofilm-Bildung durch enterotoxigene und enteropathogene Formen von E. coli. In Studien sowohl mit Tieren als auch mit Menschen zeigt E. coli Nissle 1917 eine entzündungshemmende Wirkung, stärkt die zelluläre und humorale Immunantwort und verbessert die Integrität der Darmbarriere. Sein Einsatz hat sich daher bei einer Reihe gastrointestinaler Erkrankungen klinisch bewährt, beispielsweise bei unspezifischer Diarrhö, entzündlichen Darmerkrankungen und dem RDS.
Zwar mangelt es nach wie vor an (weiteren) Toxizitätsstudien, um die gesundheitliche Unbedenklichkeit von E. coli Nissle 1917 im Rahmen zusammenfassender Meta-Analysen unstrittig bestätigen zu können, doch die lange Geschichte seines Gebrauchs und das Fehlen von Meldungen unerwünschter Ereignisse in klinischen Studien sprechen bislang dafür, dass sich der Stamm von E. coli Nissle 1917 ebenso sicher in der Praxis einsetzen lässt wie die allermeisten anderen, generell als nützlich erachteten Probiotika.
Sicherheit von Probiotika aus der Gattung „Enterococcus”
Enterococci besiedeln natürlicherweise den menschlichen Darm, wobei sie in der Regel nur einen vergleichsweise geringen prozentualen Anteil von dessen Mikroflora stellen.
Viele Jahre lang galt der Stamm E. faecium als nützlicher Organismus mit probiotischen Eigenschaften. Tierstudien zeigen, dass E. faecium gegen bekannte Pathogene wie Salmonella enteritidis und beta-hämolytische E. coli Keime wirkt, und bei Studien am Menschen konnte gezeigt werden, dass die Gabe von E. faecium eine Reihe klinischer Vorteile hervorruft, wie beispielsweise die Stärkung des Immunsystems, eine Cholesterinsenkung und die Vorbeugung gegenüber antibiotikabedingter Diarrhö.
Seit Mitte der 1990er Jahre entpuppte sich E. faecium jedoch auch als wichtiger Erreger nosokomialer Infektionen. Dieser Trend hielt an, und inzwischen gilt E. faecium seinem Geschwisterpathogen E. faecalis als ebenbürtig, was die Auslösung von im Krankenhaus erworbenen Neuinfektionen angeht. Noch beunruhigender ist jedoch, dass die meisten Varianten von E. faecium, die in solchen Fällen isoliert werden konnten, resistent gegen wichtige Antibiotika wie Ampicillin sowie Vancomycin sind, und dass viele dieser Varianten mehrfache Arzneimittelresistenzen aufweisen.
Kurz gesagt verfügen Enterokokken über eine Vielzahl virulenter Merkmale, die ihnen eine Überbevölkerung des Magen-Darm-Trakts erlauben, sobald das normalerweise im Darm vorherrschende Mikrobiom durch Antibiotika oder andere Einflussfaktoren gestört wird. Sie können dann die epitheliale Darmbarriere überwinden, Immunreaktionen des Wirts widerstehen, und schließlich das Wirtsgewebe infizieren. Diese Virulenzmerkmale scheinen nur bei Enterokokken vorzukommen.
Außerdem hat der übermäßige Einsatz von Breitband-Antibiotika in den letzten Jahrzehnten leider auch zur Selektion hoch-resistenter Stämme von E. faecium geführt. Angesichts dieser Entwicklung und der damit einher gehenden globalen Verbreitung pathogener Formen von E. faecium kann der Einsatz dieses Organismus für probiotische Zwecke nicht länger empfohlen werden.
Obere Sicherheitsgrenzen
Aktuell liegen von offizieller Seite keine oberen Sicherheits-Grenzwerte für die Einnahme von Probiotika vor. Dies mag sich auf verschiedenste Gründe zurückführen lassen, darunter u. a. folgende:
Zum einen spricht allein der gesunde Menschenverstand dafür, dass angesichts der unglaublichen mikrobiellen Besiedlungsdichte im Darm selbst sehr hohe probiotische Dosierungen kaum ungünstige Wirkungen haben können — zumindest wenn hierbei nur die nach momentanem Kenntnisstand als grundsätzlich unbedenklich einzustufenden Stämme (s. o.) zum Einsatz kommen, die ja ohnehin von Natur aus im Darm gesunder Menschen vorzufinden sein sollten!
Zum anderen wird die Unbedenklichkeit hoch dosierter Probiotika auch durch ihren jahrzehntelangen Einsatz im Rahmen zahlreicher wissenschaftlicher Studien untermauert, die sowohl an Tieren als auch an Menschen durchgeführt wurden. Hierbei wurden nämlich — obwohl die Dosierung von Probiotika in derartigen Studien in den vergangenen Jahrzehnten einem deutlichen Aufwärtstrend folgt — nach wie vor nur äußerst wenige unerwünschte Ereignisse gemeldet.
So ist es aktuell nicht ungewöhnlich, wenn in klinischen Interventionsprüfungen Probiotika in Hunderten von Milliarden kbE/Tag verabreicht werden: Beispielsweise zeigte eine von Klaire Labs® durchgeführte Studie, dass bei Nierentransplantierten auch die Gabe von 200 Milliarden kbE Lactobacillus und Bifidobacterium täglich nicht zu unerwünschten Wirkungen führte. Diese therapeutische Intervention reduzierte sogar die Häufigkeit von immunsuppressionsbedingter Diarrhö um mehr als 70%. Auch andere klinische Prüfungen, in denen eine mehrere Arten enthaltende Probiotika-Mischung eingesetzt wurde, berichteten über hohe Dosierungen. In einer neueren Studie war die tägliche Anwendung über 8 Wochen von 2,6 Billionen Organismen bei Personen mit entzündlichen Darmerkrankungen genauso sicher wie die eines Placebos und führte zu einem signifikanten Rückgang der Krankheitsaktivität.
Schlussfolgerung: Probiotika zählen zu den sichersten Nahrungsergänzungen
Probiotika sind Nahrungsergänzungsmittel mit zahlreichen gesundheitsfördernden Wirkungen und sehr wenigen gemeldeten Nebenwirkungen. In den vergangenen Jahrzehnten wurden sie in Wissenschaft und Klinik problemlos zur Behandlung einer ganzen Reihe gastrointestinaler und systemischer Erkrankungen eingesetzt.
Während es für die allermeisten Medikamente — ebenso wie für bestimmte einzelne Vitamine, Mineralstoffe oder andere orthomolekulare Substanzen, die als wertgebender Bestandteil entsprechender Nahrungsergänzungen Verwendung finden — gewisse Höchstmengen gibt, die unbedingt eingehalten werden sollten, um eine Überdosierung oder andere ungewollte Nebeneffekte zu vermeiden, konnten bislang trotz der vielen Studien, in denen Probiotika zum Einsatz kamen, keine allgemein sinnvollen Grenzwerte für die tägliche Zufuhr probiotischer Kulturen gefunden werden.
Neben den epidemiologischen Daten zu ihrer Sicherheit haben die hierzu veröffentlichten Studien so gut wie keine gravierenden Nebenwirkungen von Probiotika gezeigt, selbst wenn diese an empfindliche Patientengruppen wie Frühgeborene verabreicht wurden. Umfassende Übersichtsarbeiten, in denen Daten aus hunderten klinischer Prüfungen ausgewertet wurden, fanden entweder gar keine oder nur sehr wenige Hinweise auf vermehrte unerwünschte Wirkungen in den jeweiligen Probiotika-Interventionsgruppen gegenüber den Kontrollgruppen.
Fallberichte unerwünschter Ereignisse liegen praktisch nur für Schwerstkranke mit Verweilkathetern vor, wenn das pilzliche Probiotikum Saccharomyces boulardii verabreicht wurde. Der Einsatz dieses Probiotikums sollte daher bei katheterisierten Personen vermieden werden oder nur mit entsprechender Vorsicht erfolgen.
Klinische Studien haben außerdem gezeigt, dass Probiotika in Schwangerschaft und Stillzeit unbedenklich sind und sogar das Risiko von Frühgeburten senken können. Die ergänzende Gabe von Probiotika an Mütter und Neugeborene scheint die Häufigkeit typischer Erkrankungen des Kindesalters wie Atemwegsinfekte und Neurodermitis zu verringern. Die Beweislage für einen Zusammenhang zwischen Probiotikagabe im Säuglings- und Kleinkindalter und einem geringeren Risiko für eine nekrotisierende Enterokolitis ist gut. Zwar verfügen manche Probiotika natürlicherweise über Resistenzen gegen antimikrobielle Substanzen oder können diese vorübergehend erwerben, aber es gibt kaum Hinweise darauf, dass sie diese Resistenzmerkmale an Pathogene übertragen können.
Beobachtungs- und Forschungsdaten deuten darauf hin, dass auch nicht-traditionelle Probiotika wie Bacillus spp. und E. coli Nissle 1917 größtenteils unbedenklich sind und bei einer Reihe von Erkrankungen hilfreich sein können.
Zusammenfassung und abschließende Bemerkungen
Probiotika werden seit Jahrtausenden, nämlich seit dem ersten Verzehr fermentierter Milchprodukte, vom Menschen genutzt. Probiotika können für die normale Verdauungsfunktion sowie die endokrine und immunologische Funktion des Darms unerlässlich sein. Sie hemmen pathogene Mikroorganismen und sind therapeutisch zur Behandlung einer Vielzahl gastrointestinaler und sogar systemischer Störungen eingesetzt worden. Probiotika besiedeln den Darm nur vorübergehend und müssen, sofern sie nicht der Behandlung einer akuten Erkrankung dienen, regelmäßig verzehrt werden, um ihren Nutzen aufrechtzuerhalten. Die Auswahl geeigneter Probiotika, die einzeln oder in Kombination angewendet werden können, erfolgt am besten in der Beratung durch erfahrene medizinische Fachleute.

Probiotika in der praktischen Anwendung
1. Auflage, 2017
(auch als professionell gedrucktes Heft im DIN A5 Format erhältlich. — Sprechen Sie uns einfach im Rahmen Ihrer nächsten Bestellung über unsere üblichen Kontaktwege an.)

